Diferencia entre bromo y cloro

- 1058
- 151
- Adriana Preciado
El grupo VIIA del sistema periódico incluye los elementos fluorinos (F), cloro (CL), bromo (BR), yodo (I) y astatina (AT). Todos estos elementos se conocen bajo el nombre genérico "elementos halógenos" y tienen propiedades químicas no metálicas.

Que es bromo?
- Bromo (BR) es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales es un líquido marrón rojizo con un olor altamente irritante.
- El bromo es el número 35 en la tabla periódica y tiene una masa atómica de 79.904.
- Es menos reactivo que el cloro. Sin embargo, en condiciones normales, el bromo participa en múltiples interacciones químicas.
- Una solución acuosa de bromo molecular (2.8%) se llama agua de bromo y se usa en muchas reacciones orgánicas. En general, el bromo es muy bien soluble en solventes orgánicos. A menudo, en los compuestos, exhibe un estado de oxidación -1, pero también puede estar en cualquier estado de oxidación positivo extraño (+1, +3, +5, +7).
- En la naturaleza, el bromo ocurre en forma de una mezcla de dos isótopos estables. Está contenido como una impureza en los minerales de cloro halite (NaCl - Sal), Sylvite (KCL), Carnallita (Hexahidrato de Magnesio de potasio), etc. Su contenido en el agua de mar es de aproximadamente 1: 660 átomos de cloro.
- El uso del bromo incluye preparaciones farmacéuticas, pesticidas, colorantes, retardantes de llama, etc. En el pasado, el bromuro de potasio se ha utilizado como sedante y anticonvulsivo.

Que es el cloro?
- El cloro (CL) es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales tiene la forma de un gas de color amarillo verdoso con un olor muy irritante.
- El cloro es el número 17 en la tabla periódica y tiene una masa atómica de 35.453.
- El cloro es un elemento químico extremadamente activo. En las interacciones químicas, generalmente parece ser un oxidante fuerte y en sus compuestos químicos es más a menudo del estado de oxidación de -1. Cuando hay un oxidante más fuerte en la molécula, los átomos de cloro tienen un estado de oxidación positivo. Por ejemplo, en el ácido perclórico, el estado de oxidación de los átomos de cloro alcanza +7. El cloro puede estar presente en todos los estados de oxidación de -1 a +7, excepto +2.
- En la naturaleza, las fuentes de cloro como una sustancia simple no se conocen hasta ahora y solo ocurre en forma de compuestos químicos o disociadas en forma de iones. Los minerales que son una fuente de cloro son halita (NaCl - Sal), Sylvite (KCL), carnalita (potasio hexahidrato), etc. Los mares y los océanos contienen aniones de cloro debido a las sales disueltas. Dado que la vida en la tierra proviene de las mismas aguas saladas, el fluido interno de nuestros organismos también contiene una abundancia de iones de cloro.
- El cloro es una materia prima importante en la producción de ácido clorhídrico. Su uso en los hogares es bastante significativo porque es el ingrediente más común de los productos de limpieza bactericidas. Preparaciones que contienen cloro destruyen todas las bacterias conocidas. En forma de radicales, los átomos de cloro son extremadamente reactivos, lo que los convierte en carcinógenos fuertes.
Diferencia entre bromo y cloro
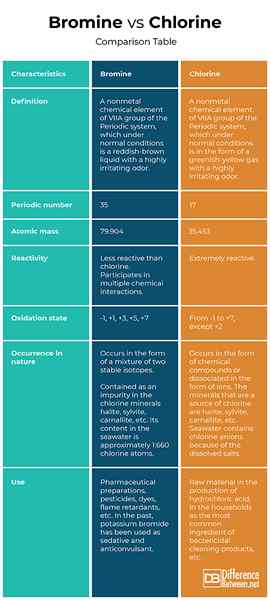
Definición
Bromo: El bromo es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales es un líquido marrón rojizo con un olor altamente irritante.
Cloro: El cloro es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales tiene la forma de un gas de color amarillo verdoso con un olor altamente irritante.
Número periódico
Bromo: El bromo es el número 35 en la tabla periódica.
Cloro: El cloro es el número 17 en la tabla periódica.
Masa atomica
Bromo: La masa atómica de bromo es 79.904.
Cloro: La masa atómica de cloro es 35.453.
Reactividad
Bromo: El bromo es menos reactivo que el cloro. Sin embargo, en condiciones normales, el bromo participa en múltiples interacciones químicas.
Cloro: El cloro es un elemento químico extremadamente activo.
Estado de oxidación
Bromo: A menudo, en los compuestos químicos, el bromo exhibe un estado de oxidación -1, pero también puede estar en cualquier estado de oxidación positivo extraño (+1, +3, +5, +7).
Cloro: El cloro puede estar presente en todos los estados de oxidación de -1 a +7, excepto +2. Es un oxidante fuerte y en sus compuestos químicos a menudo es de -1 estado de oxidación.
Ocurrencia en la naturaleza
Bromo: En la naturaleza, el bromo ocurre en forma de una mezcla de dos isótopos estables. Está contenido como una impureza en los minerales de cloro halite (NaCl - Sal), Sylvite (KCL), Carnallita (Hexahidrato de Magnesio de potasio), etc. Su contenido en el agua de mar es de aproximadamente 1: 660 átomos de cloro.
Cloro: En la naturaleza, el cloro solo ocurre en forma de compuestos químicos o disociado en forma de iones. Los minerales que son una fuente de cloro son halita (NaCl - Sal), Sylvite (KCL), carnalita (potasio hexahidrato), etc. El agua de mar contiene aniones de cloro debido a las sales disueltas.
Usar
Bromo: El uso del bromo incluye preparaciones farmacéuticas, pesticidas, colorantes, retardantes de llama, desinfección de piscinas, etc. En el pasado, el bromuro de potasio se ha utilizado como sedante y anticonvulsivo.
Cloro: El cloro se usa como materia prima en la producción de ácido clorhídrico, en los hogares como el ingrediente más común de los productos de limpieza bactericidas, para desinfectar piscinas, etc.
Bromo vs. Cloro: tabla de comparación
Resumen de Bromo vs. Cloro
- El bromo es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales es un líquido marrón rojizo con un olor altamente irritante.
- El cloro es un elemento químico no metálico del grupo VIIA del sistema periódico, que en condiciones normales tiene la forma de un gas de color amarillo verdoso con un olor altamente irritante.
- El bromo es el número 35 en la tabla periódica y el cloro es el número 17.
- La masa atómica de bromo es 79.904, la masa atómica de cloro es 35.453.
- El bromo es menos reactivo que el cloro. Sin embargo, en condiciones normales, el bromo participa en múltiples interacciones químicas.
- A menudo, en los compuestos químicos, el bromo exhibe un estado de oxidación -1, pero también puede estar en cualquier estado de oxidación positivo extraño (+1, +3, +5, +7). El cloro puede estar presente en todos los estados de oxidación de -1 a +7, excepto +2.
- En la naturaleza, el bromo ocurre en forma de una mezcla de dos isótopos estables. El cloro solo ocurre en forma de compuestos químicos o disociado en forma de iones.
- El uso del bromo incluye preparaciones farmacéuticas, pesticidas, colorantes, retardantes de llama, desinfección de piscinas, etc. En el pasado, el bromuro de potasio se ha utilizado como sedante y anticonvulsivo. El cloro se usa como materia prima en la producción de ácido clorhídrico, en los hogares como el ingrediente más común de los productos de limpieza bactericidas, para desinfectar piscinas, etc.

