Diferencia entre cis y trans

- 2116
- 160
- Maricarmen Moya
El isomerismo cis-trans consiste en la posibilidad de colocar grupos sustituyentes en uno o en diferentes lados de un plano de doble enlace o un ciclo no aromático. Los isómeros cis-trans pertenecen a los diastereómeros, ya que no son reflejos espejo entre sí. Los isómeros cis y trans se encuentran entre los compuestos orgánicos e inorgánicos.
La nomenclatura cis-trans describe la posición relativa de los sustitutos, y no proporciona una descripción estereoquímica, como la nomenclatura E, Z, aplicable solo para los alquenos.
La existencia separada de los isómeros cis y trans es posible solo debido a la alta barrera de rotación de la rotación alrededor del doble enlace.

Que es cis?
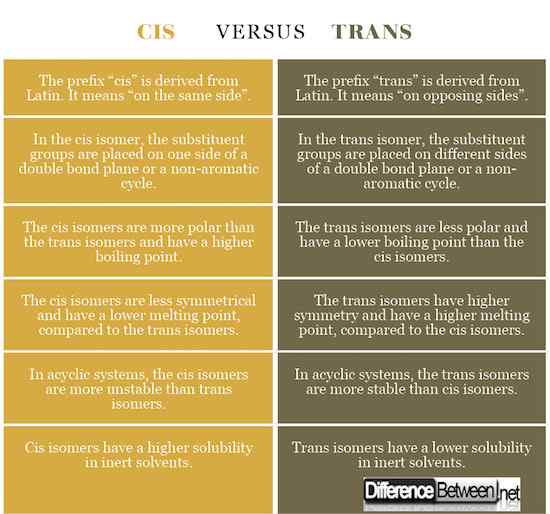
El prefijo "cis" se deriva del latín. Significa "en el mismo lado". En el isómero cis, los grupos sustituyentes se colocan en un lado de un plano de doble enlace o un ciclo no aromático.
Los isómeros cis y trans difieren en sus propiedades físicas, debido a la desigualdad en el momento dipolar general y la forma de las moléculas.
El punto de ebullición relativo está siendo determinado por la polaridad. Causa un aumento de las fuerzas intermoleculares, lo que resulta en un aumento del punto de ebullición. Los isómeros cis, que son más polares que los isómeros trans, tienen un punto de ebullición más alto. La diferencia puede ser pequeña, como es, por ejemplo, en los alquenos con cadena recta. Se observa una mayor diferencia en sustancias con enlaces polares. El ejemplo para dicha sustancia es el 1,2-dicloroeteno. El punto de ebullición de su isómero cis es 60.3 ° C, y de su isómero trans - con 12.8 ° C más bajo. La razón de la diferencia es que en el isómero cis los dos momentos dipolares de enlaces polares C-Cl se emparejan y producen un dipolo molecular general. Como resultado se producen fuerzas intermoleculares dipolo-dipolo, que elevan el punto de ebullición.
La simetría permite un mejor empaque de las sustancias sólidas. Como resultado de la diferente simetría de las moléculas, los isómeros cis y trans difieren en sus puntos de fusión. Los isómeros cis, que son menos simétricos, tienen un punto de fusión más bajo, en comparación con los isómeros trans.
Otra característica de los isómeros cis es que tienen densidades más altas que sus contrapartes trans.
Por lo general, en los sistemas acíclicos, los isómeros cis son más inestables que los isómeros trans. La razón de esto es el aumento en la interacción estérica desfavorable de los sustituyentes en los isómeros cis. En general, los isómeros cis tienen una mayor solubilidad en solventes inertes.
Que es trans?
El prefijo "trans" se deriva del latín. Significa "en lados opuestos". En el isómero trans, los grupos sustituyentes se colocan en diferentes lados de un plano de doble enlace o un ciclo no aromático.
El punto de ebullición de los isómeros trans es más bajo que en los isómeros cis. La diferencia es más significativa en sustancias con enlaces polares. En el isómero trans del 1,2-dicloroeteno, los dos momentos de enlace C-CL se cancelan entre sí y la molécula tiene un dipolo neto cero. Como resultado, no hay fuerzas intermoleculares de dipolo-dipolo, que disminuyen el punto de ebullición.
La simetría de las moléculas es la clave en la determinación del punto de fusión, debido al mejor empaque de las sustancias sólidas. Ejemplos de esto son el ácido oleico (isómero cis) y el ácido elaidic (trans isómero). El punto de fusión del isómero cis es 13.4 ° C, el isómero trans se derrite a 43 ° C. La razón de esto es que el isómero trans es más recto, empaca mejor y, por lo tanto, tiene un punto de fusión mucho más alto.
Los isómeros trans tienen densidades más bajas que sus contrapartes de la CEI. En los sistemas acíclicos, los isómeros trans son más estables que los isómeros cis. En general, los isómeros cis tienen una mayor solubilidad en solventes inertes.
Diferencia entre cis y trans
-
Definición de cis y trans
Cis: El prefijo "cis" se deriva del latín. Significa "en el mismo lado". En el isómero cis, los grupos sustituyentes se colocan en un lado de un plano de doble enlace o un ciclo no aromático.
Trans: El prefijo "trans" se deriva del latín. Significa "en lados opuestos". En el isómero trans, los grupos sustituyentes se colocan en diferentes lados de un plano de doble enlace o un ciclo no aromático.
-
Polaridad y punto de ebullición de cis y trans
Cis: La polaridad causa un aumento de las fuerzas intermoleculares, lo que resultó en un aumento del punto de ebullición. Los isómeros cis, que son más polares que los isómeros trans, tienen un punto de ebullición más alto.
Trans: Los isómeros trans son menos polares y tienen un punto de ebullición más bajo que los isómeros cis. La diferencia es más significativa en sustancias con enlaces polares.
-
Simetría y punto de fusión de cis y trans
Cis: Los isómeros cis son menos simétricos y tienen un punto de fusión más bajo, en comparación con los isómeros trans.
Trans: Los isómeros trans tienen una simetría más alta y un punto de fusión más alto, en comparación con los isómeros cis.
-
Estabilidad y solubilidad de cis y trans
Cis: En los sistemas acíclicos, los isómeros cis son más inestables que los isómeros trans. Tienen mayor solubilidad en solventes inertes.
Trans: En los sistemas acíclicos, los isómeros trans son más estables que los isómeros cis. Tienen menor solubilidad en solventes inertes.
Resumen cis vs. Trans:
- El isomerismo cis-trans consiste en la posibilidad de colocar grupos sustituyentes en uno o en diferentes lados de un plano de doble enlace o un ciclo no aromático.
- La existencia separada de los isómeros cis y trans es posible solo debido a la alta barrera de rotación de la rotación alrededor del doble enlace. Se encuentran tanto entre compuestos orgánicos como inorgánicos.
- Los prefijos "cis" y trans se derivan del latín. CIS significa "en el mismo lado", trans significa "en lados opuestos".
- En el isómero cis, los grupos sustituyentes se colocan en un lado, mientras que en el isómero trans, los grupos sustituyentes se colocan en diferentes lados de un plano de doble enlace o un ciclo no aromático.
- La polaridad provoca un aumento de las fuerzas intermoleculares, lo que resulta en un aumento del punto de ebullición. Los isómeros cis son más polares que los isómeros trans y tienen un punto de ebullición más alto. La diferencia es más significativa en sustancias con enlaces polares.
- Los isómeros cis son menos simétricos y tienen un punto de fusión más bajo, en comparación con los isómeros trans.
- En los sistemas acíclicos, los isómeros cis son más inestables que los isómeros trans. Tienen mayor solubilidad en solventes inertes.