Diferencia entre la geometría de electrones y la geometría molecular
- 822
- 161
- Adriana Preciado
La química es el estudio de la materia y se ocupa de las muchas formas en que un tipo de materia se puede cambiar a otros tipos. Se sabe que toda la materia está hecha de uno o más de aproximadamente cien tipos diferentes de átomo. Todos los átomos están compuestos por tres partículas fundamentales: protones, electrones y neutrones. Una molécula consiste en un grupo de dos o más átomos unidos en un patrón geométrico definido. Cuando dos o más átomos se mantienen fuertemente unidos para formar una molécula, hay enlaces químicos entre cada átomo y sus vecinos cercanos. La forma de una molécula transmite una gran cantidad de información y el primer paso para comprender la química de una molécula es conocer su geometría.
La geometría molecular simplemente se refiere a la disposición tridimensional de los átomos que constituyen una molécula. El término estructura se usa bastante en un sentido para indicar simplemente la conectividad de los átomos. La forma de una molécula se determina en términos de las distancias entre los núcleos atómicos que se unen. La geometría de las moléculas está determinada por la teoría de la repulsión de electrones de la carcasa de valencia (VESPR): un modelo utilizado para determinar la forma general de una molécula basada en el número de pares de electrones alrededor de un átomo central. La geometría de una molécula se da como la geometría de electrones o la geometría molecular.

¿Qué es la geometría de electrones??
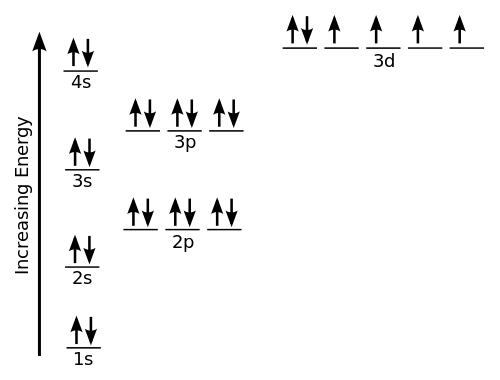
El término geometría de electrones se refiere al nombre de la geometría del par de electrones/grupos/dominios en el átomo central, ya sea que estén uniendo electrones o electrones no unidos. Los pares de electrones se definen como electrones en pares o enlaces, pares solitarios o, a veces, un solo electrón no apareado. Debido a que los electrones siempre están en movimiento constante y sus rutas no pueden definirse con precisión, la disposición de los electrones en una molécula se describe en términos de una distribución de densidad de electrones. Tomemos un ejemplo de metano, cuya fórmula química es CH4. Aquí, el átomo central es carbono con 4 electrones de valencia y 4 electrones compartidos de hidrógeno con 1 carbono para formar 4 enlaces covalentes. Esto significa que hay un total de 8 electrones alrededor del carbono y no hay enlaces individuales, por lo que el número de pares solitarios aquí es 0. Sugiere ch4 es la geometría tetraédrica.
¿Qué es la geometría molecular??
La geometría molecular se usa para determinar la forma de una molécula. Simplemente se refiere a la disposición o estructura tridimensional de los átomos en una molécula. Comprender la geometría molecular de un compuesto ayuda a determinar la reactividad, la polaridad, el color, la fase de la materia y el magnetismo. La geometría de una molécula generalmente se describe en términos de longitudes de enlace, ángulos de enlace y ángulos torsionales. Para moléculas pequeñas, la fórmula molecular y una tabla de longitudes y ángulos de enlace estándar pueden ser todo lo que se requiere para determinar la geometría de la molécula. A diferencia de la geometría de electrones, se predice considerando solo pares de electrones. Tomemos un ejemplo de agua (h2O). Aquí, el oxígeno (O) es el átomo central con 6 electrones de valencia, por lo que requiere 2 electrones más de 2 átomos de hidrógeno para completar su octeto. Entonces hay 4 grupos de electrones dispuestos en forma tetraédrica. También hay 2 pares de un solo enlace, por lo que la forma resultante está doblada.
Diferencia entre la geometría de electrones y la geometría molecular
Terminología para geometría de electrones y geometría molecular
El término geometría de electrones se refiere al nombre de la geometría del par de electrones/grupos/dominios en el átomo central, ya sea que estén uniendo electrones o electrones no unidos. Ayuda a comprender cómo se organizan diferentes grupos de electrones en una molécula. La geometría molecular, por otro lado, determina la forma de una molécula y es la estructura tridimensional de los átomos en una molécula. Ayuda a comprender todo el átomo y su disposición.
Geometría
La geometría de una molécula se determina sobre la base de solo pares de electrones de unión, pero no el número de pares de electrones. Es la forma tridimensional que ocupa una molécula en el espacio. La geometría molecular también se define como las posiciones de los núcleos atómicos en una molécula. La geometría de electrones de una molécula, por otro lado, se determina sobre la base de pares de electrones de unión y pares de electrones solitarios. La geometría de electrones se puede determinar utilizando la teoría VESPR.
Ejemplos de geometría de electrones y geometría molecular
Uno de los muchos ejemplos de geometría de electrones tetraédricos es el amoníaco (NH3). El átomo central aquí es N y cuatro pares de electrones se distribuyen en forma de tetraedro con solo un par solitario de electrones. Por lo tanto, la geometría electrónica de NH3 es tetraédrica. Sin embargo, su geometría molecular es la piramidal trigonal porque los ángulos de enlace son de 107 grados, ya que los átomos de hidrógeno son repelidos por el par solitario de electrones alrededor de nitrógeno alrededor de nitrógeno. Del mismo modo, la geometría molecular del agua (H2O) está doblado porque hay 2 pares de enlaces individuales.
Geometría de electrones vs. Geometría molecular: tabla de comparación

Resumen de la geometría de electrones vs. Geometría molecular
Tanto la geometría de electrones como la geometría molecular siguen el modelo de repulsión de pares de electrones de valencia (VESPR) para determinar la forma general de una molécula basada en el número de pares de electrones alrededor de un átomo central. Sin embargo, la geometría molecular se determina únicamente en función de los pares de electrones de enlace, no el número de pares de electrones, mientras que la geometría de electrones se determina sobre la base de los pares de electrones de unión y los pares de electrones solitarios. Cuando no hay pares solitarios de electrones en una molécula, la geometría de electrones es la misma que la forma molecular. Como dijimos, la forma de una molécula dice mucho al respecto y el primer paso para comprender la química de una molécula es determinar su geometría.

