Diferencia entre exotérmico y endotérmico
- 3757
- 870
- Teresa Sánchez
 Exotérmico y endotérmico
Exotérmico y endotérmico
En química hemos aprendido sobre reacciones exotérmicas y endotérmicas. Pero no se sabe cómo es aplicable en nuestra vida diaria.
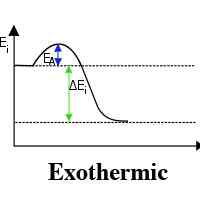
En primer lugar, una reacción exotérmica es aquella en la que el calor se produce como uno de los productos finales.Ejemplos de reacciones exotérmicas de nuestra vida diaria son la combustión como la quema de una vela, madera y reacciones de neutralización. En una reacción endotérmica, sucede lo contrario. En esta reacción, el calor se absorbe. O más exactamente, se requiere calor para completar la reacción. La fotosíntesis en las plantas es una reacción endotérmica química. En este proceso, los cloroplastos en las hojas absorben la luz del sol. Sin luz solar o alguna otra fuente de energía similar, esta reacción no se puede completar.
En reacciones exotérmicas, el cambio de entalpía siempre es negativo, mientras que en reacciones endotérmicas el cambio de entalpía siempre es positivo. Esto se debe a la liberación y absorción de energía térmica en las reacciones, respectivamente. Los productos finales son estables en reacciones exotérmicas. Los productos finales de las reacciones endotérmicas son menos estables. Esto se debe a los enlaces débiles formados.
'Endo' significa absorber y, por lo tanto, en las reacciones endotérmicas, la energía se absorbe del entorno circundante externo. Entonces los alrededores pierden energía y, como resultado, el 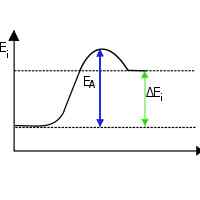 El producto final tiene un nivel de energía más alto que los reactivos. Debido a este mayor enlace de energía, el producto es menos estable. Y la mayoría de las reacciones endotérmicas no son espontáneas. 'Exo' significa emitir y, por lo tanto, la energía se libera en reacciones exotérmicas. Como resultado, los alrededores se calientan. Y la mayoría de las reacciones exotérmicas son espontáneas.
El producto final tiene un nivel de energía más alto que los reactivos. Debido a este mayor enlace de energía, el producto es menos estable. Y la mayoría de las reacciones endotérmicas no son espontáneas. 'Exo' significa emitir y, por lo tanto, la energía se libera en reacciones exotérmicas. Como resultado, los alrededores se calientan. Y la mayoría de las reacciones exotérmicas son espontáneas.
Cuando encendemos un fósforo, es una reacción exotérmica. En esta reacción, cuando golpeamos el palo, la energía almacenada se libera como calor espontáneamente. Y la llama tendrá menor energía que el calor producido. La energía que se libera se almacena previamente en el fósforo y, por lo tanto, no requiere ninguna energía externa para que ocurra la reacción.
Cuando el hielo se derrite, se debe al calor. El entorno circundante tendrá una temperatura más alta que el hielo y esta energía térmica es absorbida por el hielo. La estabilidad de los enlaces se reduce y, como resultado, y el hielo se derrite en líquido.
Algunas reacciones exotérmicas en nuestras vidas son la digestión de los alimentos en nuestro cuerpo, reacciones de combustión, condensaciones de agua, explosiones de bombas y agregando un metal alcalino al agua. Así que ahora debes tener una idea de lo que son las reacciones exotérmicas y endotérmicas
 Encuentra libros en Amazon sobre reacciones exotérmicas y endotérmicas.
Encuentra libros en Amazon sobre reacciones exotérmicas y endotérmicas.

