Diferencia entre enlaces de hidrógeno y enlaces covalentes
- 2359
- 205
- Horacio Apodaca

El tema deja muy claro que el artículo se basa en algunos conceptos de la química. Para aquellos de ustedes que conocen los conceptos básicos de la unión química, es fácil comprender que la discusión es sobre dos tipos de enlaces. En cuanto a otros, digamos que entre los muchos enlaces químicos que ocurren entre átomos y moléculas, vamos a discutir y diferenciar dos tipos muy importantes de enlaces, a saber, enlaces de hidrógeno y enlaces covalentes.
Muy a menudo es que la gente confunda a los dos. Esto se debe a una definición vaga que se ofrece para explicar estos en relación con otro tipo de enlaces. La definición más simple que se ofrece es que un enlace entre dos no metales suele ser covalente, mientras que un enlace entre un metal y un no metal es iónico. Estas definiciones son bastante generalizadas y hay muchas excepciones, así como contradicciones. En primer lugar, debe tenerse en cuenta que todos los enlaces entre dos no metales no entran en la categoría de enlaces covalentes; También hay otros enlaces, uno de los cuales es un enlace de hidrógeno.
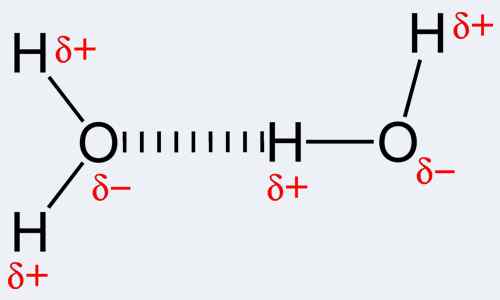
Por definición, un enlace covalente es una forma de un enlace químico que ocurre debido al intercambio de pares de electrones entre los mismos o distintos átomos. La unión covalente, a su vez, se refiere al equilibrio de fuerza estable (atractivo y repulsivo) entre los átomos cuando comparten electrones. El intercambio permite que cada átomo involucrado alcance una cubierta externa que sea equivalente a una carcasa de valencia completa o una carcasa externa. Esto representa una configuración estable de electrones. En contraste con esto, un enlace de hidrógeno es en realidad el nombre de la atracción electrostática entre tipos especiales de moléculas, conocidas como moléculas polares. El enlace ocurre de forma única cuando un átomo de hidrógeno que ya está unido a un átomo altamente electronegativo (uno de los tres; oxígeno, nitrógeno o fluorino) experimenta otra fuerza de atracción de un átomo cercano que también es altamente electronegativo. Tenga en cuenta que el hidrógeno debe estar allí para que ocurra un enlace de hidrógeno y, por lo tanto, el nombre del enlace. Además, uno de los tres átomos mencionados anteriormente debe estar unido. Esto se debe a que el nitrógeno, el fluorino y el oxígeno son muy electronegativos, es decir, atraer electrones hacia sí mismos. Esto hace que el hidrógeno se comporte como una partícula cargada positivamente, ya que los electrones cargados negativamente se han atraído hacia el nitrógeno, flúor u oxígeno correspondiente. Por lo tanto, esta partícula de hidrógeno, que ahora es positiva, se atrae fácilmente hacia otro átomo electronegativo debido a su negatividad. Usar el nombre de enlace de hidrógeno para esta interacción química es más como usar un nombre inapropiado porque no hay un enlace verdadero que se forme. En efecto, hay atracciones DI-pole a di-pole.
Las interacciones que tienen lugar en la unión covalente incluyen unión de metal a metal, tres enlaces de electrones centrales, interacciones agósticas, enlace π y unión σ. De hecho, es notable que la covalencia sea la mayor entre átomos que tienen electronegatividades similares. Esto implica que los dos átomos no necesitan ser del mismo elemento, sino que deben tener electronegatividad que sea comparable y cercana para permitir enlaces más fuertes. A diferencia de esto, los enlaces de hidrógeno son intermoleculares, es decir, se producen entre moléculas o entre diferentes partes de una molécula. Los enlaces de hidrógeno son bastante fuertes; más fuertes que las fuerzas de van der Waals pero son más débiles que los enlaces covalentes e iónicos. Ejemplos de moléculas donde se produce unión de hidrógeno incluye agua, así como algunos moleculsos orgánicos, como proteínas, ADN, etc.
Resumen de las diferencias expresadas en los puntos
1. Enlace covalente: un enlace químico que ocurre debido al intercambio de pares de electrones entre los mismos o distintos átomos, la unión covalente se refiere al equilibrio de fuerza estable (tanto atractivo como repulsivo) entre los átomos cuando comparten electrones, compartiendo permite que cada átomo esté involucrado una cubierta externa que es equivalente a una cubierta de valencia completa o una carcasa exterior; Un enlace de hidrógeno es la atracción electrostática entre tipos especiales de moléculas, conocidas como moléculas polares. El enlace ocurre de forma única cuando un átomo de hidrógeno ya unido a un átomo altamente electronegativo (uno de los tres; oxígeno, nitrógeno o fluorino) experimenta otra fuerza de atracción de un átomo cercano que también es altamente electronegativo
2. La unión covalente puede ocurrir entre una gran variedad de átomos; Los enlaces de hidrógeno requieren hidrógeno y uno de oxígeno, nitrógeno o fluorino
3. Los enlaces covalentes son más fuertes que los enlaces de hidrógeno

