Diferencia entre la masa molar y la masa molecular
- 792
- 192
- Adriana Preciado
Los químicos frecuentemente miden sustancias mediante el uso de masa molar y masa molecular. Un ejemplo sería determinar el número de moléculas en un cilindro. La química estudia la interacción de átomos y moléculas a escala atómica.

¿Qué es una masa molecular??
En primer lugar, la molécula se refiere a la composición de átomos similares o diferentes dispuestos en relaciones. Las moléculas pueden formar compuestos químicos sujetos a las propiedades físicas y químicas de cada molécula.
En pocas palabras, una masa molecular se refiere a la masa total de una sustancia. Resume las masas promedio de átomos individuales en una molécula de esa sustancia particular.
Para determinar la masa molecular de un compuesto X, debe agregar las masas atómicas de todos los elementos en la composición, incluidas sus multiplicaciones según los subíndices en la fórmula.
Ilustraremos con un ejemplo a continuación. Estas masas atómicas se toman directamente de la tabla periódica de elementos. Se miden en unidades de masa atómica (AMU) y también lo es la masa molecular.
Ejemplo 1:
Determinar la masa molecular de H2O y CH3CH2OH.
Respuesta:
Debe evaluar las composiciones de las fórmulas moleculares dadas y derivar sus masas atómicas de la tabla periódica. Tenga en cuenta los subíndices.
Por ejemplo, H2O indica que hay dos átomos de hidrógeno y un átomo de oxígeno. La masa atómica de hidrógeno es, de la tabla periódica, 1.0079 amu y el de oxígeno es de 15.9994. La masa molecular del compuesto es 2 (1.0079) + 15.9994 = 18.0152 amu.
Y para determinar la masa molecular de etanol, la otra fórmula dada en la pregunta, seguimos los mismos pasos. Hay 2 átomos de carbono, 6 átomos de hidrógeno y 1 átomo de oxígeno. La masa atómica de átomo de carbono es 12.011 amu. Dicho esto, la masa molecular de CH3CH2OH es 2 (12.011) + 6 (1.0079) + 1 (15.9994) = 46.069 amu. Para su ejercicio, calcule la fórmula molecular de etano (C2H4) y CO2.
¿Qué es la masa molar??
Ahora con respecto al concepto de masa molar, se define como la masa en kilogramos o gramos de un topo de una sustancia. Por lo general, las unidades para la masa molar son gramo/mol. Un lunar de un elemento de oxígeno tiene una masa de 15.9994 gramos. Así, la masa molar sería 15.9994 g/mol. Para un compuesto de dióxido de carbono, por ejemplo, la masa molar se define como la masa de 1 mol de moléculas en ese compuesto. Número de avogadro, 6.022 x 1023 se usa a menudo para relacionar el número de átomos, moléculas y otras unidades a las que una masa molar es igual a. Por ejemplo, una masa molar de H2O sería igual a la masa en gramos por lunar de 6.022 x 1023 moléculas de agua. Si esto suena demasiado técnico, ilustraremos con un ejemplo a continuación:
Ejemplo 2:
Determinar la masa molar de etanol.
Respuesta:
En el primer ejemplo, determinamos la masa molecular de etanol (C2H5OH). No se confunda con una fórmula diferente como la mencionada. Acabamos de jugar con los arreglos estructurales de la fórmula de etanol, aunque la proporción de átomos sigue siendo la misma.
El etanol contiene 6.022 x 1023moléculas, y la masa molar es igual a la masa de etanol que contiene estas moléculas. Encontramos que la masa molecular de etanol es 46.069 Unidades de masa atómica en nuestro ejemplo anterior. Se sigue el mismo procedimiento para calcular la masa molar.
Un lunar de etanol tiene 2 átomos de carbono moles, 6 moles de átomos de hidrógeno y un mol de oxígeno átomo. Tomando las masas atómicas de la tabla del período, encontramos que la masa molar es 2 (12.011g) + 6 (1.0079g) + 15.9994g que es igual a 46.069 g/mes. Observe el mismo valor pero diferentes unidades.
NÓTESE BIEN: La masa molar de cualquier sustancia química se refiere a su masa atómica o masa molecular en gramos por lunar. Los valores son los mismos pero diferentes unidades.
Ejercicio 2:
Calcule la masa molar de fosfato de calcio (CA3 (PO4) 2). La respuesta debe ser 310.177 g/mol.
Con respecto al carbono, la masa molar de un carbón natural con ser diferente del derivado de la tabla de período que pertenece al isótopo de carbono-12. Naturalmente, el carbono contiene carbono-12, carbono-13 y carbono-14. Pero un lunar de carbono todavía contiene 6.022 x 1023 pero con diferentes proporciones de estos isótopos.
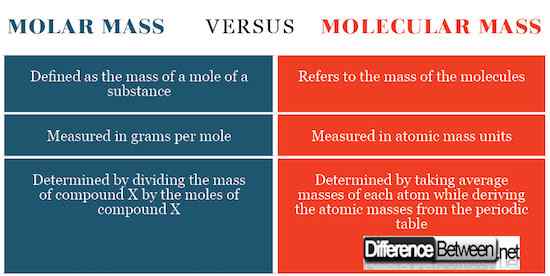
Diferencias entre la masa molar y la masa molecular
Cálculo para la masa molar y la masa molecular
La masa molar se determina dividiendo la masa total de la sustancia, que es las masas promedio de cada átomo por la cantidad en los moles. La cifra resultante será gramos por lunar o kilogramos por lunar. La masa molecular se determina calculando la masa de la sustancia relacionada con el 1/12 del isótopo de carbono-12.
Definición de masa molar y masa molecular
La masa molecular se refiere a la masa de las moléculas, mientras que la masa molar se refiere a la masa de un topo de una sustancia.
Unidades SI para masa molar y masa molecular
La masa molar se expresa como gramos por lunar, mientras que una masa molecular se expresa como unidades de masa atómica. Esta expresión de unidades SI se remonta a cómo estos conceptos se definen como mencionados.
Resumen de masa molar vs. Masa molecular
- La masa molar y la masa molecular son conceptos importantes en la química
- La masa molar se expresa en gramos por mol o kilogramos por lunar, mientras que la masa molecular se expresa en unidades de masa atómica. La masa molar es básicamente sin unidad.
- Calculamos la masa molar dividiendo la masa de la sustancia por la cantidad y calculamos la masa molecular tomando la masa promedio de las unidades de la sustancia
- Tienen los mismos valores pero diferentes unidades SI.
- « Diferencia entre un libro de pasaporte y una tarjeta de pasaporte
- Diferencia entre explícito e implícito »

