Diferencia entre nitrato y nitrito
- 2126
- 451
- Pablo Carranza

Que es el nitrato?
El ion nitrato (no3) es una base conjugada del ácido nítrico. Consiste en un nitrógeno y tres átomos de oxígeno. El átomo de nitrógeno se encuentra en el centro y está rodeado de átomos de oxígeno, que están unidos de manera idéntica en una conformación trigonal plana. La masa molar del anión nitrato es de 62 g/mol. Se disocia en agua para dar nitrato hidroxilo iones.
Los nitratos son compuestos químicos, sales del ácido nítrico. Son fácilmente solubles. Los nitratos se usan en:
- Agricultura (fertilizantes minerales);
- Industria alimentaria (colorantes y conservantes);
- Producción de pinturas, medicamentos, plásticos, vidrio, explosivos, etc.
Los nitratos se encuentran en el suelo, el agua y los alimentos (de origen vegetal y animal). A bajas concentraciones (1-40 mg/m3) también están presentes en el aire como. Los nitratos se sintetizan naturalmente por bacterias nitrogenadas como un paso intermedio en la formación de nitrógeno. Las concentraciones naturales en las plantas y el agua son generalmente bajas. Su cantidad en tierra cultivable y en el agua normalmente no excede los 10 mg/l. Se puede aumentar mediante el uso de fertilizantes de nitrógeno, la introducción del estiércol de ganado y otras fuentes en el suelo.
El contenido de nitrato de las plantas varía, dependiendo de su cantidad en el suelo. De la solución del suelo, las plantas extraen nitrógeno, aminoácidos, proteínas, vitaminas y otras sustancias, principalmente en forma de nitratos. Si la planta extrae más nitratos que la enzima nitrato reductasa que puede procesar, se acumulan en ella. La actividad de la nitrato reductasa depende de factores como la luz, la temperatura y el estrés hídrico.
Los nitratos mismos no son tóxicos. Peligrosos para la salud humana son las nitritas y nitrosaminas. Ambos pueden formarse a partir de los nitratos antes o después de la ingestión de alimentos o agua.
Los nitratos ingresan al cuerpo humano a través de alimentos y agua potable. Los alimentos ricos en nitratos son las verduras y los productos cárnicos (salchichas, carnes ahumadas). Mucho menos de insignificante es el contenido de nitrato en productos lácteos y pescado. Algunas plantas tienen la capacidad de acumular más nitratos. Estos son lechuga, zanahorias, espinacas, eneldo, remolacha roja, rábano rojo, calabacín, brócoli, etc.
Los nitratos en el aire pueden actuar como irritantes respiratorios. Los estudios han demostrado un aumento en los ataques asmáticos asociados con un aumento del contenido de nitrato en el aire.
La dosis máxima permitida las 24 horas de potasio y nitrato de sodio para humanos es de hasta 5 mg/kg. El envenenamiento ocurre a una dosis de 4 g/24 h, la dosis letal humana es de 8-15 g/24h.
¿Qué es el nitrito??
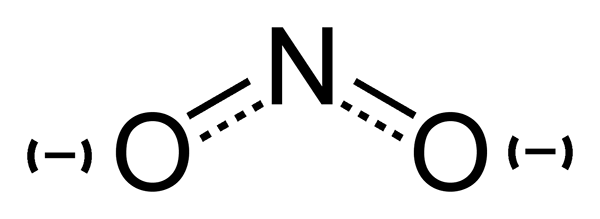
El ion nitrito (no2) es una base conjugada del ácido nitroso. El anión es simétrico. El átomo de nitrógeno se encuentra en el centro y está rodeado por dos átomos de oxígeno, que están unidos idénticamente. La masa molar del anión nitrito es de 46 g/mol.
Los nitritos son compuestos químicos, sales o ésteres del ácido nitroso. Se utilizan ampliamente en la producción de productos de carne y pescado. Tienen acción bactericida. Su reacción con la mioglobina le da a la carne un aspecto fresco y color rojo rosado.
Los humanos pueden estar expuestos a nitratos de varias maneras. La fertilización excesiva de nitrógeno aumenta el contenido de nitrato en las plantas, y respectivamente en humanos (a través de los alimentos). En el cuerpo humano, los nitratos se reducen a nitritos. Las plantas superiores también pueden asimilar el nitrito del suelo. La conversión microbiológica de nitratos en nitritos puede ocurrir cuando se almacenan vegetales frescos, especialmente a temperatura ambiente.
Los nitratos, cuando se ingieren, se clasifican como "probablemente cancerígenos para los humanos". Se unen a la hemoglobina en la sangre y forman un compuesto llamado metahemoglobina. Es incapaz de transportar oxígeno a los órganos y tejidos, lo que conduce a una condición conocida como metemoglobinemia, caracterizada por hematomas de la piel y las membranas mucosas (cianosis).
Los nitratos son más peligrosos cuando se convierten en nitrito antes de que se tragan. Esta conversión puede ocurrir cuando los alimentos se almacenan de manera incorrecta (alta temperatura y contenido de oxígeno reducido en la habitación) o durante la cocción, especialmente durante la freír.
Los nitritos dañan las estructuras celulares de diferentes órganos y sistemas directamente, dependiendo de la dosis. Perturban el transporte de oxígeno, causan daño tóxico a los sistemas enzimáticos, causan cambios mutagénicos, cancerígenos y otros cambios subcelulares, reducen la actividad del sistema inmune.
En baja acidez de ácido gástrico, los nitritos se pueden convertir en nitrosaminas, que tienen un efecto cancerígeno.
La dosis máxima permitida de nitrito durante 24 horas es 0.2 mg/kg. La dosis letal humana es 0.18-2.5 g/24 h. Se cree que tomar 0.5 g de nitrito pueden conducir a 1-2 g - a envenenamiento severo.
Diferencia entre nitrato y nitrito
-
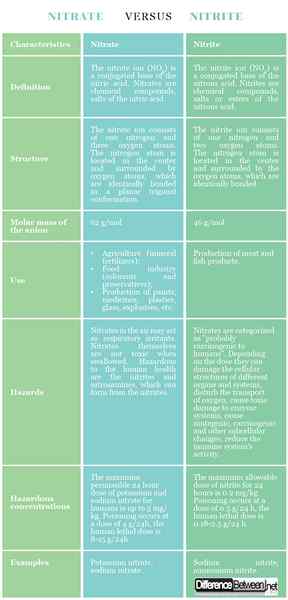
Definición
Nitrato: El ion nitrato (no3) es una base conjugada del ácido nítrico. Los nitratos son compuestos químicos, sales del ácido nítrico.
Nitrito: El ion nitrito (no2) es una base conjugada del ácido nitroso. Los nitritos son compuestos químicos, sales o ésteres del ácido nitroso.
-
Estructura
Nitrato: El ion de nitrato consta de un nitrógeno y tres átomos de oxígeno. El átomo de nitrógeno se encuentra en el centro y está rodeado de átomos de oxígeno, que están unidos de manera idéntica en una conformación trigonal plana.
Nitrito: El ion nitrito consta de un nitrógeno y dos átomos de oxígeno. El átomo de nitrógeno se encuentra en el centro y está rodeado por los átomos de oxígeno, que están unidos idénticamente.
-
Masa molar
Nitrato: La masa molar del anión nitrato es de 62 g/mol.
Nitrito: La masa molar del anión nitrito es de 46 g/mol.
-
Usar
Nitrato: Los nitratos se utilizan en la agricultura (fertilizantes minerales), la industria alimentaria (colorantes y conservantes), la producción de pinturas, medicamentos, plásticos, vidrio, explosivos, etc.
Nitrito: Los nitritos se utilizan en la producción de productos de carne y pescado.
-
Peligros
Nitrato: Los nitratos en el aire pueden actuar como irritantes respiratorios. Los nitratos mismos no son tóxicos cuando se tragan. Peligrosos para la salud humana son los nitritos y nitrosaminas, que pueden formarse a partir de los nitratos.
Nitrito: Los nitratos se clasifican como "probablemente cancerígenos para los humanos". Dependiendo de la dosis, pueden dañar las estructuras celulares de diferentes órganos y sistemas, perturbar el transporte de oxígeno, causar daño tóxico a los sistemas enzimáticos, causar cambios mutagénicos, cancerígenos y otros cambios subcelulares, reducen la actividad del sistema inmune.
-
Concentraciones peligrosas
Nitrato: La dosis máxima permitida las 24 horas de potasio y nitrato de sodio para humanos es de hasta 5 mg/kg. El envenenamiento ocurre a una dosis de 4 g/24 h, la dosis letal humana es de 8-15 g/24h.
Nitrito: La dosis máxima permitida de nitrito durante 24 horas es 0.2 mg/kg. El envenenamiento ocurre a una dosis de 0.5 g/24 h, la dosis letal humana es 0.18-2.5 g/24 h.
-
Ejemplos
Nitrato: Nitrato de potasio, nitrato de sodio.
Nitrito: Nitrito de sodio, nitrito de amonio.
Resumen:
- El ion nitrato (no3) es una base conjugada del ácido nítrico. Los nitratos son compuestos químicos, sales del ácido nítrico.
- El ion nitrito (no2) es una base conjugada del ácido nitroso. Los nitritos son compuestos químicos, sales o ésteres del ácido nitroso.
- El ion de nitrato consta de un nitrógeno y tres átomos de oxígeno. El átomo de nitrógeno se encuentra en el centro y está rodeado de átomos de oxígeno, que están unidos de manera idéntica en una conformación trigonal plana. El ion nitrito consta de un nitrógeno y dos átomos de oxígeno. El átomo de nitrógeno se encuentra en el centro y está rodeado por los átomos de oxígeno, que están unidos idénticamente.
- La masa molar del anión nitrato es de 62 g/mol, mientras que la masa molar del anión nitrito es de 46 g/moles.
- Los nitratos se utilizan en la agricultura, la industria alimentaria, la producción de pinturas, medicamentos, plásticos, vidrio, explosivos, etc. Los nitritos se utilizan en la producción de productos de carne y pescado.
- Los nitratos en el aire pueden actuar como irritantes respiratorios. Los nitratos mismos no son tóxicos cuando se tragan. Peligrosos para la salud humana son los nitritos y nitrosaminas, que pueden formarse a partir de los nitratos. Los nitratos se clasifican como "probablemente cancerígenos para los humanos". Dependiendo de la dosis, pueden dañar las estructuras celulares de diferentes órganos y sistemas, perturbar el transporte de oxígeno, causar daño tóxico a los sistemas enzimáticos, causar cambios mutagénicos, cancerígenos y otros cambios subcelulares, reducen la actividad del sistema inmune.
- La dosis máxima permitida las 24 horas de potasio y nitrato de sodio para humanos es de hasta 5 mg/kg. El envenenamiento ocurre a una dosis de 4 g/24 h, la dosis letal es de 8-15 g/24h. La dosis máxima permitida de nitrito durante 24 horas es 0.2 mg/kg. El envenenamiento ocurre a una dosis de 0.5 g/24 h, la dosis letal es 0.18-2.5 g/24 h.

