Diferencia entre períodos y grupos
- 4041
- 66
- Rubén Alarcón
Los períodos y grupos son las dos clasificaciones importantes que los antiguos químicos usaron para organizar la tabla periódica icónica en columnas y filas. Los períodos son las filas horizontales, mientras que los grupos, también llamados familias, son las columnas verticales. Los elementos se organizaron en grupos y períodos basados en ciertas características como propiedades químicas/físicas para grupos y configuraciones de electrones para los períodos. El artículo desarrolla más diferencias entre los períodos y los grupos.

¿Qué son los períodos??
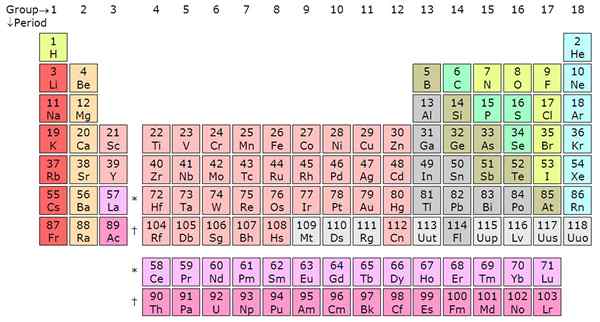
Contando desde la izquierda hasta el extremo derecho en la tabla periódica, es el período. Típicamente hay 7 períodos en una tabla periódica y cada período denota un nuevo carcasa de energía. Desde hidrógeno hasta Francium en el período 7, los elementos aumentan en las orbitales atómicas. Esto significa que los electrones del elemento se representarán en un número específico de niveles de energía en línea con la etiqueta periódica.
El litio (Li), por ejemplo, tiene dos conchas de energía porque está en el período 2, mientras que el potasio (k) tiene cuatro conchas de energía desde el período 4. Esta tendencia es cierta para todos los demás elementos. Dentro de un período, los elementos comparten los electrones de la carcasa externa (valencia). Por ejemplo, el hidrógeno y el helio están en el mismo grupo y tienen un electrón en la cubierta exterior. Observe que el primer período tiene solo dos elementos. El segundo y el tercer período tienen 8 elementos cada uno.
Los períodos 4 y 5 tienen 18 elementos. La tabla periódica tiene, en total, 18 grupos según el sistema de nombres de IUPAC. Los períodos 6 y 7 son las excepciones, ya que contienen 32 elementos en total. Esto explica por qué la tabla periódica se acorta eliminando parte del período 6 y 7 y mostrando justo debajo de la tabla periódica. El periódico sería grande si no se eliminaran los actínidos y los lantánidos. Estos elementos separados son metales de transición internos y llenan el bloque F en los orbitales atómicos. Los lantánidos incluyen los elementos de 58 a 71, mientras que los actínidos incluyen los elementos de 89 a 103.
La otra característica de que los elementos dentro de un período comparten es un aumento en la energía de ionización. Átomos dentro de un aumento de período en los números atómicos a medida que se agregan cada vez más protones. Esto aumenta la atracción en el núcleo y será relativamente difícil eliminar un electrón. La carga nuclear aumenta en la tabla periódica. Además, la electronegatividad aumenta a medida que avanza de izquierda a derecha en todo el período. La afinidad electrónica también aumenta a medida que se agregan más electrones, lo que aumenta una fuerte fuerza de atracción con el núcleo.
¿Qué son los grupos??
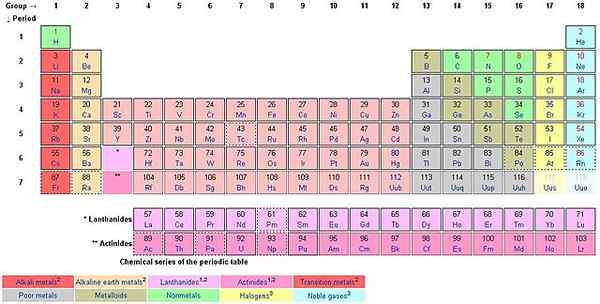
A medida que cuenta de arriba a abajo a lo largo de las columnas, está contando los grupos. El estilo de nombres europeo ꟷ ahora adoptado como el estilo de nombres de IUPAC, se usa para nombrar a los grupos de 1 a 18. El estilo estadounidense usa As y BS.
Cada uno de los 18 grupos lleva un nombre. Por ejemplo, el primer grupo se conoce como la familia Lithium (Alkali Metals), Grupo 2 La familia Beryllium (Alkaline Earth Metals, Grupo 3 The Scandium Family, Group 4 The Titanium Family, Group 5 La Familia Vanadium, Grupo 6 La Familia de Cromio , Grupo 7 The Manganese Family, Group 8 The Iron Family, Group 9 The Cobalt Family, Group 10 The Nickel Family, Group 11 The Copper Family (Coinage Metals), Grupo 12 La familia Zinc (Metales volátiles), Grupo 13 La familia Boron (ICOASAGENS), Familia de carbono del Grupo 14 (Cristalógenos, Tetrels), Grupo 15 La familia de nitrógeno (Pentels), Grupo 16 La familia de oxígeno (calcógenos), Grupo 17 La familia Fluorine (Halógenos) y Grupo 18 La familia de helio o neón ( Gases nobles).
Los elementos dentro de un grupo comparten propiedades químicas o físicas. El grupo 18, por ejemplo, se conoce como gases nobles. No son reactivos con otros elementos. La regla octeta de 8 electrones en la cubierta exterior se aplica perfectamente a los nobles gases. Todos los demás elementos se esfuerzan por lograr la regla del octeto. El hidrógeno no sigue la regla del octeto y también lo es el helio, aunque es estable y parte de los nobles gases.
La tabla del período tiene una mezcla de metales, no metales y metaloides (semimetales). Hay un cierto elemento de agrupación según sus propiedades similares y estos incluyen metales álcali, metales de tierra alcalina, metales de transición (lantánidos, metales de tierras raras y actínidos), no metales, metaloides, gases nobles, halógenos y metales básicos.
También hay una tendencia a aumentar las propiedades a medida que baja o sube el grupo. A medida que sube, la propiedad de Electron Affinity 9Electron Loving) aumenta. Cuando cae por el grupo, las conchas de energía aumentan y, por lo tanto, una atracción en el núcleo disminuye, por lo tanto, la afinidad de los electrones disminuye a medida que baja. Electronegativo también disminuye a medida que avanza en el grupo debido a un aumento en los niveles de energía en el grupo. Los electrones en la cubierta externa tienden a estar lejos del núcleo y, por lo tanto, la piscina disminuye.
Diferencias clave entre períodos y grupos
Ubicación en la tabla periódica
Los períodos son filas horizontales, mientras que los grupos son las columnas verticales en la tabla periódica. Hay 7 períodos y 18 grupos. El período 6 y 7 tienen 32 elementos debido a la adición de los actínidos y los lantánidos.
Definir características
Elementos en un grupo comparten propiedades químicas o físicas similares. Tienen el mismo número de electrones de valencia. Por otro lado, los elementos en el mismo período comparten la misma configuración de electrones.
Electronegatividad
Electronegativo disminuye a medida que avanza en el grupo y aumenta a medida que sube debido a una mayor atracción en el núcleo como resultado de menos niveles de energía. La electronegatividad aumenta a medida que va de izquierda a derecha a lo largo del período con la adición de más protones a medida que aumentan los números atómicos.
Períodos vs. Grupos: forma tabular

Resumen de períodos vs. Grupos
- La tabla periódica se organiza en períodos y grupos
- Los grupos son columnas verticales, mientras que los períodos son las filas horizontales
- Los elementos en un grupo comparten propiedades químicas o físicas, mientras que los elementos en un período tienen las mismas configuraciones de electrones
- Hay 7 períodos y 18 grupos en la tabla periódica
- La electronegatividad aumenta de izquierda a derecha dentro del período y de abajo hacia arriba dentro del grupo

