Diferencia entre fósforo y fosfato
- 4321
- 1171
- Miguel Arias
¿Qué es el fósforo??
El fósforo (P) es un elemento químico no metal multivalente del grupo VA, no 15 del sistema periódico. Su masa molar es 30.97. Se conocen veintitrés isótopos de fósforo, pero solo uno de ellos es estable.

El fósforo es un elemento altamente reactivo. Reacciona con oxígeno, halógenos, azufre y muchos metales. Debido a su alta reactividad, el fósforo no se puede encontrar como un elemento libre en la tierra.
El átomo de fósforo contiene cinco electrones de valencia en su capa externa. En compuestos con metales e hidrógeno, el fósforo exhibe un grado de oxidación de -3, y en interacción con elementos más electronegativos, como oxígeno, flúor, etc., Los grados de oxidación son +3 o +5.
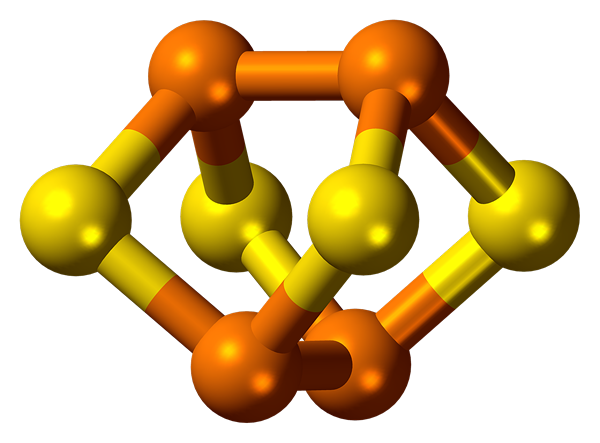
El fósforo se caracteriza por la alotropía. Forma varias sustancias simples que difieren en estructura y propiedades. Los más ampliamente distribuidos son el fósforo blanco y rojo.
El fósforo blanco consiste en P4 moléculas. Es una sustancia blanca tipo cera con un tinte amarillo que brilla en la oscuridad. El fósforo blanco no es soluble en agua, sino que es soluble en el disulfuro de carbono. Es venenoso. Es altamente reactivo y puede encenderse espontáneamente.
El fósforo rojo tiene una red atómica cristalina. No se disuelve en el agua y el disulfuro de carbono. No es venenoso y tiene una actividad más baja en comparación con el fósforo blanco.
Las modificaciones alotrópicas del fósforo son interconvertibles.
¿Qué es el fosfato??
El fosfato es un derivado químico del ácido fosfórico, que contiene el ion fosfato (PO3-4). El ion fosfato puede formar una variedad de sales diferentes. Formalmente, cualquier sal de un fósforo oxoácido es un fosfato.
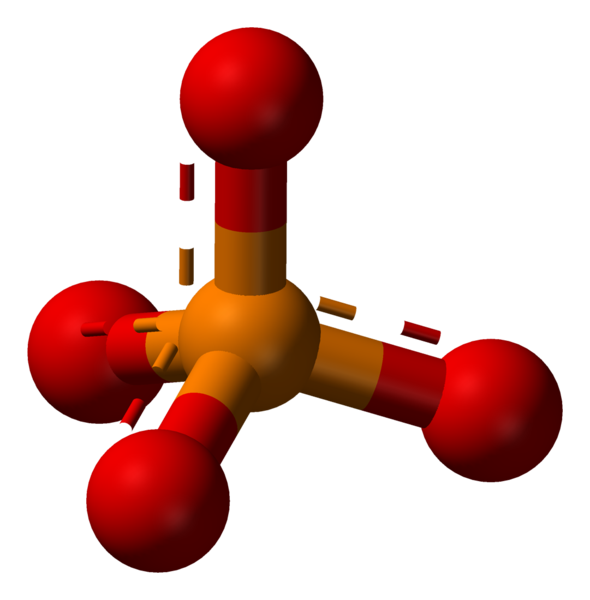
El ion fosfato es un ion poliatómico con una disposición tetraédrica de los átomos. Consiste en un átomo de fósforo, ubicado en el centro y rodeado por cuatro átomos de oxígeno. La masa molar del ion fosfato es 94.97 g/mol.
Dependiendo del número de átomos de fósforo, los fosfatos se pueden dividir en cuatro grupos principales: ortofosfatos, pirofosfatos, tripolifosfatos y polifosfatos. Cada uno de estos grupos tiene sus propias propiedades funcionales específicas.
Diferencia entre fósforo y fosfato
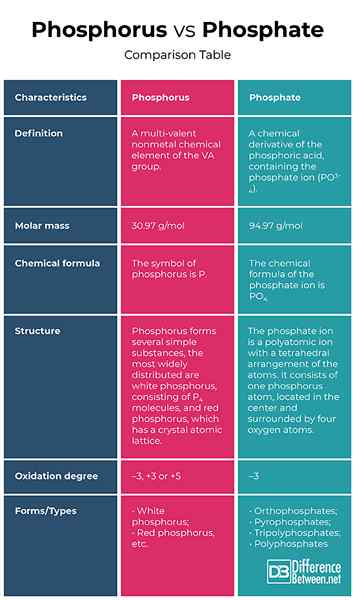
Definición
Fósforo: El fosforus es un elemento químico no metal multivalente del grupo VA.
Fosfato: El fosfato es un derivado químico del ácido fosfórico, que contiene el ion fosfato (PO3-4). Formalmente, cualquier sal de un fósforo oxoácido es un fosfato.
Masa molar
Fósforo: La masa molar del fósforo es 30.97 g/mol.
Fosfato: La masa molar del ion fosfato es 94.97 g/mol.
Fórmula química
Fósforo: El símbolo del fósforo es P.
Fosfato: La fórmula química del ion fosfato es PO4.
Estructura
Fósforo: El fósforo forma varias sustancias simples, las más ampliamente distribuidas son el fósforo blanco, que consiste en P4 moléculas y fósforo rojo, que tiene una red atómica cristalina.
Fosfato: El ion fosfato es un ion poliatómico con una disposición tetraédrica de los átomos. Consiste en un átomo de fósforo, ubicado en el centro y rodeado por cuatro átomos de oxígeno.
Oxidación
Fósforo: En compuestos con metales e hidrógeno, el fósforo exhibe un grado de oxidación de -3, y en interacción con elementos más electronegativos, como oxígeno, flúor, etc., El grado de oxidación es +3 o +5.
Fosfato: El fosfato exhibe un grado de oxidación de -3.
Formularios/tipos
Fósforo: El fósforo se caracteriza por la alotropía y forma varias sustancias simples que difieren en estructura y propiedades. Los más ampliamente distribuidos son el fósforo blanco y rojo.
Fosfato: Dependiendo del número de átomos de fósforo, los fosfatos son ortofosfatos, pirofosfatos, tripolifosfatos y polifosfatos.
Fósforo vs. Fosfato: tabla de comparación
Resumen del fósforo vs. Fosfato:
- El fosforus es un elemento químico no metal multivalente del grupo VA.
- El fosfato es un derivado químico del ácido fosfórico, que contiene el ion fosfato (PO3-4). Formalmente, cualquier sal de un fósforo oxoácido es un fosfato.
- La masa molar del fósforo es 30.97 g/mol. La masa molar del ion fosfato es 94.97 g/mol.
- El símbolo del fósforo es P. La fórmula química del ion fosfato es PO4.
- El fósforo blanco consiste en P4 Moléculas, el fósforo rojo tiene una red atómica cristalina. El ion fosfato es un ion poliatómico con una disposición tetraédrica de los átomos, que consiste en un átomo de fósforo, ubicado en el centro y rodeado por cuatro átomos de oxígeno.
- El fósforo exhibe un grado de oxidación de -3, +3 o +5. El fosfato exhibe un grado de oxidación de -3.
- El fósforo forma varias sustancias simples que difieren en estructura y propiedades, las más ampliamente distribuidas son el fósforo blanco y rojo. Dependiendo del número de átomos de fósforo, los fosfatos son ortofosfatos, pirofosfatos, tripolifosfatos y polifosfatos.

