Diferencia entre Sigma y Pi Bond
- 4684
- 1178
- Rubén Alarcón
¿Qué es Sigma Bond??
Los enlaces sigma son enlaces entre los átomos dentro de las moléculas formadas a lo largo del eje que conecta los núcleos unidos de los átomos.
Enlaces moleculares
Las moléculas se forman cuando los átomos intercambian o comparten electrones a través de la unión química. Esencialmente hay tres tipos de enlaces. Enlaces iónicos, enlaces metálicos y enlaces covalentes. En los enlaces iónicos, los átomos simplemente intercambiarán un electrón para que un átomo se cargue positivamente y el otro cargado negativamente, lo que hace que se sientan atraídos por la fuerza electromagnética. En los enlaces metálicos, los electrones se distribuirán de manera uniforme a través de toda la molécula creando un mar de electrones libres y delocalizados que envuelven iones cargados positivamente atraídos por los electrones.
Dentro de los enlaces covalentes, los electrones se comparten y la forma en que se comparten es a través de las nubes de probabilidad de los electrones, y los orbitales en los que se encuentran, superpuestos de una manera que es más o menos simétrica.
Orbitales y enlaces sigma
Los orbitales son regiones alrededor de los átomos asociados con ciertos niveles de energía. Los electrones en los orbitales más lejos del núcleo tendrán más energía que los electrones en los orbitales más cercanos al núcleo. Cuando los orbitales de un átomo se superponen con los orbitales de otro átomo, forman orbitales moleculares que permiten enlaces moleculares que, por supuesto, permiten moléculas.
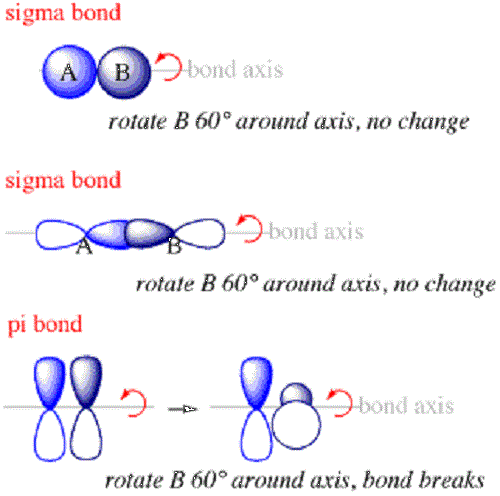
Los enlaces Sigma son el primer tipo de enlace que se formará entre los átomos. Dentro de un enlace sigma, las nubes de probabilidad de electrones estarán a lo largo del eje que conecta los núcleos de los átomos unidos. Los enlaces Sigma generalmente se formarán cuando s Los orbitales de diferentes átomos se superponen para crear un enlace. Siempre se formarán a lo largo del eje entre los dos núcleos porque el s El orbital está dispuesto en algo como una esfera alrededor del núcleo.
Sigma Bonds y Sigma Orbitals
Los electrones que componen el enlace sigma estarán dentro de los orbitales sigma y, por lo tanto, estarán en algún lugar a lo largo del eje que conecta los núcleos de los átomos unidos. Sin embargo, el enlace Sigma puede ser estable o inestable dependiendo de si los electrones están en un orbital de unión Sigma o un orbital anti-enlace.
Los orbitales de unión Sigma estarán en el espacio entre los núcleos, mientras que los orbitales anti-unión estarán a lo largo del eje que conecta los núcleos pero en los lados de los átomos opuestos al espacio entre ellos. El enlace Sigma será estable si hay más electrones en los orbitales de enlace e inestables si hay más en los orbitales de antibonding o si hay un número igual de electrones en ambos.

¿Qué es PI Bond??
Los enlaces PI son enlaces entre átomos dentro de las moléculas donde los electrones están por encima y por debajo del eje que conecta los núcleos de los átomos unidos pero no a lo largo del eje. Son el segundo tipo de enlace que se formará dentro de una molécula después del enlace Sigma.
Pi Bonds y pag orbitales
La razón por la que se forman PI por encima y por debajo del eje de unión, pero no a lo largo, se debe a que se forman generalmente de los orbitales superpuestos como pag orbitales en los átomos unidos. Estos orbitales no tienen una densidad de electrones en el núcleo. Como resultado, los electrones componen los enlaces PI que se forman desde la superposición pag Los orbitales siempre se agruparán en una región que no está directamente adyacente al núcleo. Los enlaces PI también pueden formarse entre otros orbitales atómicos, como d orbitales que tienen características en común con pag orbitales.
Pi Bonds y PI Orbitals
Cuando pag Los orbitales de los diferentes átomos se superponen, crean orbitales PI moleculares que permiten que se formen enlaces PI. El enlace puede ser una vez más estable o inestable dependiendo del orbital en el que se encuentre el electrón. El enlace PI será estable si hay más electrones en las orbitales de enlace PI. Será inestable si hay más en los orbitales anti-Bonding o si un número igual en ambos.
Similitudes entre los enlaces sigma y los bonos PI
Los enlaces sigma y los enlaces PI se basan en orbitales moleculares específicos que se derivan de la superposición de orbitales atómicos particulares, por ejemplo, s orbitales en el caso de los enlaces sigma y pag Orbitales en el caso de los bonos PI. También pueden ser estables o inestables dependiendo de si los electrones están en los orbitales moleculares de unión o los orbitales moleculares anti-enlace.
Diferencias entre los enlaces sigma y los enlaces PI
A pesar de sus similitudes, hay diferencias importantes.
- Los electrones que forman enlaces sigma se distribuirán en el espacio a lo largo del eje que conecta los núcleos unidos, mientras que los electrones dentro de los enlaces PI se distribuirán por encima y por debajo del eje, pero no a lo largo de él.
- Los enlaces sigma son los primeros enlaces que se forman entre los átomos dentro de las moléculas, mientras que los enlaces PI son los segundos.
- Los enlaces sigma a menudo se forman por la combinación de s orbitales en diferentes átomos, mientras que los enlaces PI se forman a partir de la combinación de pag y orbitales similares en diferentes átomos.
- Además, la orientación de los orbitales superpuestos que forman enlaces PI serán perpendiculares a la de los orbitales superpuestos que forman enlaces Sigma.
Sigma Bonds vs. Pi Bonds
| Vínculo sigma | Pi Bond |
| Los orbitales atómicos se superponen a lo largo del eje de enlace | Los orbitales atómicos se superponen por encima y por debajo del eje de enlace |
| Los primeros enlaces se forman entre átomos dentro de las moléculas | Segundos enlaces para formarse entre átomos dentro de las moléculas |
| Formado a partir de orbitales superpuestos como s orbitales | Formado a partir de orbitales superpuestos como pag orbitales |
| Orbitales superpuestos perpendiculares a los de los enlaces PI | Orbitales superpuestos perpendiculares a los de los enlaces de Sigma |
Resumen: Sigma y Pi Bonds
El enlace sigma es un enlace entre los átomos dentro de una molécula que se forma a menudo por s Orbitales superpuestos a lo largo del eje que conecta los núcleos unidos. Es el primero en formarse y su estabilidad depende de cómo se distribuyan los electrones en los orbitales de enlace Sigma y antibondación. Los enlaces PI son enlaces moleculares formados a menudo por superposición pag orbitales de diferentes átomos. Los electrones que forman enlaces PI se distribuirán por encima y por debajo del eje que conecta los núcleos de los átomos unidos pero no a lo largo del eje. La estabilidad de estos enlaces también depende de los orbitales PI de enlace y antibondación. Los enlaces Sigma serán los primeros enlaces que se forman dentro de las moléculas, mientras que los enlaces PI serán los segundos enlaces en formar. Los enlaces PI también se forman a partir de orbitales atómicos que están orientados perpendiculares a los que forman enlaces sigma.
- « Diferencia entre la prohibición de viajes y el estado de emergencia
- Diferencia entre debajo y debajo »

