Compuesto vs. Elemento
- 679
- 0
- Juan Carlos Rodrígez
Elementos y compuestos se encuentran sustancias químicas puras que se encuentran en la naturaleza. El diferencia entre un elemento y un compuesto es que un elemento es una sustancia hecha de el mismo tipo de átomos, mientras que un compuesto está hecho de diferentes elementos en proporciones definidas. Ejemplos de elementos incluyen hierro, cobre, hidrógeno y oxígeno. Ejemplos de compuestos incluir agua (h2O) y sal (cloruro de sodio - NaCl).
Los elementos se enumeran de acuerdo con su número atómico en la tabla periódica. Entre los 117 elementos conocidos, 94 se producen naturalmente como carbono, oxígeno, hidrógeno, etc. 22 se producen artificialmente habiendo sufrido cambios radiactivos. La razón de esto es su inestabilidad debido a la cual se someten a una descomposición radiactiva durante un período de tiempo dando lugar a nuevos elementos durante el proceso como uranio, torio, bismuto, etc. Los elementos se combinan en relaciones fijas y dan lugar a compuestos estables debido a enlaces químicos que facilitan la formación de compuestos.
Cuadro comparativo
| Compuesto | Elemento | |
|---|---|---|
| Definición | Un compuesto contiene átomos de diferentes elementos combinados químicamente en una relación fija. | Un elemento es una sustancia química pura hecha de mismo tipo de átomo. |
| Composición | Los compuestos contienen diferentes elementos en una relación fija dispuesta de manera definida a través de enlaces químicos. Contienen solo un tipo de molécula. Los elementos que componen el compuesto se combinan químicamente. | Los elementos contienen solo un tipo de átomo. Cada átomo tiene el mismo número atómico I.mi., el mismo número de protones en su núcleo. |
| Capacidad para romper | Un compuesto puede separarse en sustancias más simples mediante métodos/reacciones químicas. | Los elementos no se pueden descomponer en sustancias más simples mediante reacciones químicas. |
| Representación | Un compuesto se representa utilizando su fórmula química que representa los símbolos de sus elementos constituyentes y el número de átomos de cada elemento en una molécula del compuesto. | Un elemento se representa usando símbolos. |
| Tipos | Se puede crear una cantidad enorme, prácticamente ilimitada. Los compuestos se clasifican en compuestos moleculares, compuestos iónicos, compuestos intermetálicos y complejos. | Hay alrededor de 117 elementos que se han observado. Puede clasificarse como metal, no metal o metaloide. |
| Ejemplos | Agua (H2O), cloruro de sodio (NaCl), bicarbonato de sodio (NAHCO3) y ácido clorhídrico (HCL) son ejemplos de compuestos. | Hidrógeno (H), oxígeno (O), sodio (NA), cloro (CL), carbono (C), hierro (Fe), cobre (Cu), plata (Ag) y oro (AU) son ejemplos de elementos. |
Diferencias en las propiedades
Elementos se distinguen por su nombre, símbolo, número atómico, punto de fusión, punto de ebullición, densidad y energías de ionización. En la tabla periódica, los elementos se organizan de acuerdo con su número atómico y se agrupan de acuerdo con propiedades químicas similares y se representan por sus símbolos.
- Número atómico - el número atómico se denota por la carta Z y es el número de protones presentes en el núcleo del átomo del elemento. Delantero.gramo. El carbono tiene 6 protones en su núcleo y para carbono, z = 6. El número de protones también es indicativo de carga eléctrica o número de electrones presentes en el núcleo que determina las propiedades químicas del elemento.
- Masa atomica - la carta A Indica la masa atómica del elemento que es el número total de protones y neutrones en el núcleo de un átomo del elemento. Los isótopos de los mismos elementos difieren en sus masas atómicas.
- Isótopos - Los isótopos de un elemento tienen el mismo número de protones en su núcleo pero difieren en el número de neutrones. Los elementos naturales tienen más de un isótopo estable. Por lo tanto, los isótopos tienen propiedades químicas similares (debido al mismo número de protones) pero diferentes propiedades nucleares (debido a diferentes números de neutrones). Delantero.gramo. El carbono tiene tres isótopos, carbono - 12, carbono -13 y carbono - 14.
- Alotropos - Los átomos de un elemento pueden formar enlaces entre sí en más de una forma, lo que lleva a la diferencia en sus propiedades químicas. Delantero.gramo. El carbono se une en un tetraedro para formar diamante y capas de hexágonos de grafito de formas de carbono.
Compuestos están compuestos de diferentes elementos en una proporción fija. Por ejemplo, 1 átomo de sodio (NA) se combina con 1 átomo de cloro (CL) para formar una molécula del compuesto de cloruro de sodio (NaCl). Los elementos en un compuesto no siempre conservan sus propiedades originales y no pueden separarse por medios físicos. La combinación de elementos es facilitado por su valencia. La valencia se define como el número de átomos de hidrógeno requeridos que pueden combinarse con un átomo del elemento que forma el compuesto. La mayoría de los compuestos pueden existir como sólidos (temperaturas lo suficientemente bajas) y pueden descomponerse mediante la aplicación de calor. A veces, los elementos extraños están atrapados dentro de la estructura cristalina de los compuestos que les dan una estructura no homogénea. Los compuestos se representan por su fórmula química que sigue al sistema de colinas en el que los átomos de carbono se enumeran primero, seguido de átomos de hidrógeno después de lo cual los elementos se enumeran en orden alfabético.
Visualizando las diferencias
Esta imagen muestra las diferencias entre elementos y compuestos a nivel atómico. Los elementos tienen solo 1 tipo de átomos; Los compuestos tienen más de 1. Elementos y compuestos son ambas sustancias; difieren de las mezclas donde diferentes sustancias se mezclan pero no a través de enlaces atómicos.
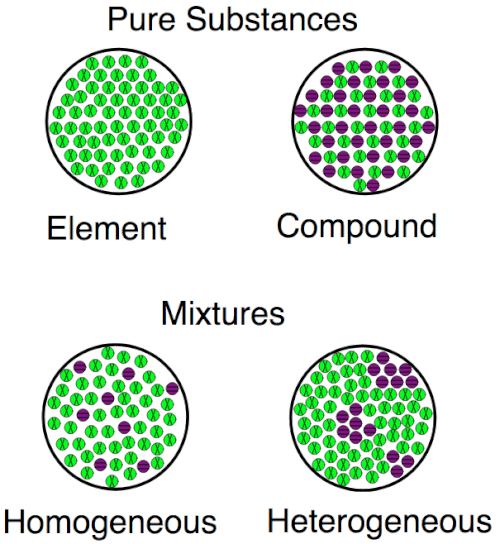 Una visualización para las diferencias entre elementos, compuestos y mezclas, tanto homogéneos como heterogéneos.
Una visualización para las diferencias entre elementos, compuestos y mezclas, tanto homogéneos como heterogéneos. Historia de elementos y compuestos
Elementos se utilizaron inicialmente como referencia a cualquier estado de materia como líquido, gas, aire, sólido, etc. Las tradiciones indias, japonesas y griegas se refieren a cinco elementos, a saber, aire, agua, tierra, fuego y éter. Aristóteles conceptualizó un nuevo quinto elemento llamado 'quintaesencia', que aparentemente formó los cielos. A medida que la investigación continuó, muchos científicos eminentes allanaron el camino para la comprensión y la descripción actuales de los elementos. Entre ellos, el trabajo de Robert Boyle, Antoine Lavoisier, Dmitri Mendeleev son particularmente notables. Lavoisier fue el primero en hacer una lista de elementos químicos y Mendeleev fue el primero en organizar elementos de acuerdo con su número atómico en la tabla periódica. La definición más actual de un elemento es otorgada por los estudios realizados por Henry Moseley, que establece que el número atómico de un átomo se expresa físicamente por su carga nuclear.
Antes del siglo XIX el uso del plazo compuesto También podría significar una mezcla. Fue en el siglo XIX que el significado de un compuesto se podía distinguir de una mezcla. Alquimistas como Joseph Louis Proust, Dalton y Berthollet y sus estudios en varios compuestos han dado a la química moderna la definición actual de compuesto. El trabajo de Proust se demostró al mundo de la química que los compuestos se hicieron una composición constante de los elementos respectivos.
Número CAS
Cada sustancia química se identifica por su identificador numérico único: el número de CAS (servicio de resúmenes químicos). Por lo tanto, cada compuesto químico y elemento tiene un número CAS. Esto hace que las búsquedas de bases de datos para elementos y compuestos sean más convenientes.

