Enlaces covalentes vs. Enlaces iónicos
- 4291
- 294
- Elvira Arteaga
Hay dos tipos de enlaces atómicos - enlaces iónicos y enlaces covalentes. Difieren en su estructura y propiedades. Enlaces covalentes consisten en pares de electrones compartidos por dos átomos y se unen los átomos en una orientación fija. Se requieren energías relativamente altas para romperlas (50 - 200 kcal/mol). Si dos átomos pueden formar un enlace covalente depende de su electronegatividad i.mi. la potencia de un átomo en una molécula para atraer electrones a sí mismo. Si dos átomos difieren considerablemente en su electronegatividad, como lo hacen el sodio y el cloruro, entonces uno de los átomos perderá su electrón por el otro átomo. Esto da como resultado un ion cargado positivamente (catión) e ion cargado negativamente (anión). El vínculo entre estos dos iones se llama enlace iónico.
Cuadro comparativo
| Enlaces covalentes | Enlaces iónicos | |
|---|---|---|
| Qué es? | La unión covalente es una forma de unión química entre dos átomos no metálicos que se caracteriza por el intercambio de pares de electrones entre los átomos y otros enlaces covalentes. | El enlace iónico, también conocido como enlace electrovalente, es un tipo de enlace formado a partir de la atracción electrostática entre iones cargados opuestos en un compuesto químico. Este tipo de enlaces ocurren principalmente entre un átomo metálico y no metálico. |
| Formación | Se forma un enlace covalente entre dos no metales que tienen electronegatividades similares. Ninguno de los átomos es lo suficientemente "fuerte" para atraer electrones del otro. Para la estabilización, comparten sus electrones de la órbita molecular externa con otros. | Se forma un enlace iónico entre un metal y un no metal. Los no metales (-ve ion) son "más fuertes" que el metal (+ve ion) y pueden obtener electrones muy fácilmente del metal. Estos dos iones opuestos se atraen entre sí y forman el vínculo iónico. |
| Ocurre entre | Dos no metales | Un metal y otro no metal |
| Electrones | Los electrones se comparten en enlaces covalentes. | En los enlaces iónicos, los electrones se transfieren de un átomo a otro, lo que resulta en dos iones cargados, uno cargado positivamente y otro cargado negativamente. Los dos iones se sienten atraídos entre sí y forman un vínculo iónico. |
| Ejemplos | Metano (CH4), ácido clórico hidrático (HCL) | Cloruro de sodio (NaCl), ácido sulfúrico (H2SO4) |
| Punto de fusion | Bajo | Alto |
| Disolver en agua? | Varía | Sí |
| Polaridad | Bajo | Alto |
| Forma | Forma definida | Sin forma definitiva |
| Punto de ebullición | Bajo | Alto |
| Estado a temperatura ambiente | Líquido o gaseoso | Sólido |
| Consistencia | Suave | Frágil |
Sobre enlaces covalentes e iónicos
El enlace covalente se forma cuando dos átomos pueden compartir electrones, mientras que el enlace iónico se forma cuando el "intercambio" es tan desigual que un electrón del átomo A se pierde por completo en el átomo B, lo que resulta en un par de iones.
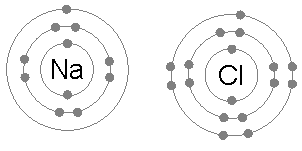
Cada átomo consta de protones, neutrones y electrones. En el centro del átomo, los neutrones y los protones permanecen juntos. Pero los electrones giran en órbita alrededor del centro. Cada una de estas órbitas moleculares puede tener un cierto número de electrones para formar un átomo estable. Pero aparte del gas inerte, esta configuración no está presente con la mayoría de los átomos. Entonces, para estabilizar el átomo, cada átomo comparte la mitad de sus electrones.
La unión covalente es una forma de unión química entre dos átomos no metálicos que se caracteriza por el intercambio de pares de electrones entre los átomos y otros enlaces covalentes. El enlace iónico, también conocido como enlace electrovalente, es un tipo de enlace formado a partir de la atracción electrostática entre iones cargados opuestos en un compuesto químico. Este tipo de enlaces ocurre principalmente entre un átomo metálico y no metálico.
Formación y ejemplos
Los enlaces covalentes se forman como resultado del intercambio de uno o más pares de electrones de enlace. Las electro negatividades (capacidad de atracción de electrones) de los dos átomos unidos son iguales o la diferencia no es mayor que 1.7. Mientras la diferencia de electro-negatividad no sea mayor que 1.7, los átomos solo pueden compartir los electrones de unión.
 Un modelo de enlaces covalentes dobles y individuales de carbono dentro de un anillo de benceno.
Un modelo de enlaces covalentes dobles y individuales de carbono dentro de un anillo de benceno. Por ejemplo, consideremos una molécula de metano i.mi.Pez4. Carbon tiene 6 electrones y su configuración electrónica es 1S22S22P2, I.mi. Tiene 4 electrones en su órbita externa. Según la regla de octate (establece que los átomos tienden a ganar, perder o compartir electrones para que cada átomo tenga un nivel de energía más externo que típicamente es 8 electrones.), para estar en un estado estable, necesita 4 electrones más. Por lo tanto, forma unión covalente con hidrógeno (1S1), y al compartir electrones con hidrógeno forma metano o CH4.
Si la diferencia de electro-negatividad es mayor que 1.7 Entonces, el átomo electronegativo más alto tiene una capacidad de atraer electrónica que es lo suficientemente grande como para forzar la transferencia de electrones del átomo electronegativo menor. Esto causa la formación de enlaces iónicos.
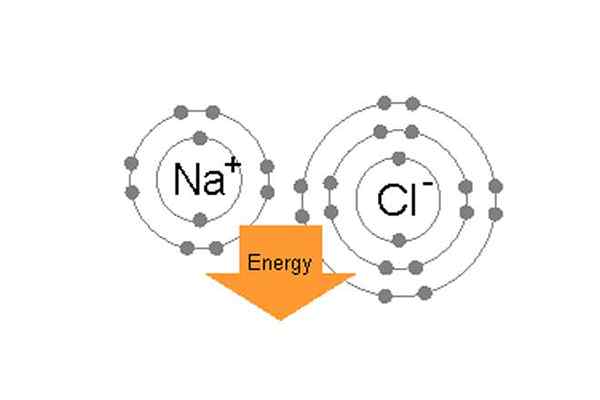
 La unión de sodio y cloro ibonalmente para formar cloruro de sodio.
La unión de sodio y cloro ibonalmente para formar cloruro de sodio. Por ejemplo, en la sal de tabla común (NaCl), los átomos individuales son sodio y cloro. El cloro tiene siete electrones de valencia en su órbita externa, pero para estar en condición estable, necesita ocho electrones en órbita externa. Por otro lado, el sodio tiene un electrón de valencia y también necesita ocho electrones. Dado que el cloro tiene una alta electro-negatividad, 3.16 en comparación con el 0 de sodio.9, (entonces la diferencia entre su electro-negatividad es más de 1.7) El cloro puede atraer fácilmente el electrón de valencia de sodio. De esta manera forman un enlace iónico, y comparten los electrones del otro y ambos tendrán 8 electrones en su carcasa externa.
Características de los enlaces
Los enlaces covalentes tienen una forma definida y predecible y tienen bajos puntos de fusión y ebullición. Se pueden dividir fácilmente en su estructura primaria, ya que los átomos están cerca para compartir los electrones. Estos son en su mayoría gaseosos e incluso una ligera carga negativa o positiva en los extremos opuestos de un enlace covalente les da polaridad molecular.
Los enlaces iónicos normalmente forman compuestos cristalinos y tienen puntos de fusión más altos y puntos de ebullición en comparación con los compuestos covalentes. Estos realizan electricidad en estado fundido o de solución y son enlaces extremadamente polares. La mayoría de ellos son solubles en agua pero insolubles en solventes no polares. Requieren mucha más energía que unión covalente para romper el enlace entre ellos.
La razón de la diferencia en los puntos de fusión y ebullición para enlaces iónicos y covalentes es que la cantidad de energía requerida para interrumpir las fuerzas intermoleculares entre las moléculas formadas a través de enlaces covalentes es mucho menor que la energía requerida para romper los enlaces iónicos en un compuesto iónico cristalino.

