Diferencia entre adiabático, isotérmico e isobárico
- 3337
- 1051
- Lourdes Fuentes

Que es adiabatic?
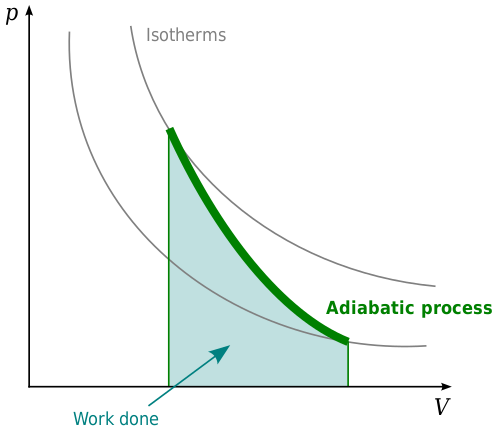
Un sistema o proceso adiabático es uno en el que no hay un cambio neto en la energía térmica. Los procesos adiabáticos están relacionados con la primera ley de la termodinámica. Esta ley establece que cuando la energía térmica se coloca en un sistema, cambiará la energía interna del sistema o funcionará. Esto está relacionado con la ley de la conservación de la energía que los estados que importan y la energía no se pueden crear ni destruir. En el contexto de la termodinámica, la energía térmica en un sistema debe hacer algo. Cambiará la energía interna del sistema, funcionará o alguna combinación de ambos. No puede simplemente desaparecer.
En un sistema adiabático, la presión, el volumen y la temperatura cambiarán de tal manera que la energía térmica permanezca constante. Los procesos adiabáticos se ven más claramente en gases. El calentamiento adiabático en un gas hará que la temperatura aumente a medida que aumente la presión sobre el gas. Si la presión sobre el gas disminuye, esto hará que la temperatura disminuya, lo que resulta en un enfriamiento adiabático. Con el calentamiento adiabático, se comprimirá el gas y, por lo tanto, el medio se realizará en el gas en el medio. Si se produce un enfriamiento adiabático, esto dará como resultado la expansión del gas y el gas funcionará en el medio ambiente.
Un ejemplo en el que los procesos adiabáticos son importantes están en el contexto de un pistón, como un pistón en un motor diesel. A medida que aumenta la presión del pistón, el gas se contraerá. Con la descompresión, el gas se expandirá nuevamente, moviendo el pistón. Esto está controlado por procesos adiabáticos.
Los procesos adiabáticos son importantes en meteorología. Si aumenta una parcela de aire, la presión sobre la parcela de aire disminuirá y esto hará que la temperatura del aire disminuya debido al enfriamiento adiabático. Por otro lado, si se empuja una masa de aire contra el suelo, hará que la presión sobre la masa de aire aumente, calentando la masa de aire. Debido a que la presión del aire disminuye con la altitud, la temperatura disminuirá con la altura en la atmósfera. La tasa a la que la temperatura disminuye al aumentar la altitud se conoce como la tasa de lapso adiabática.
Que es isotérmico?
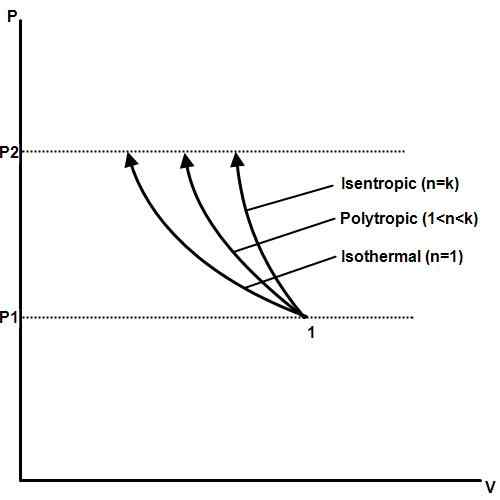
Un proceso isotérmico es uno en el que la temperatura permanece constante incluso si la presión y el volumen cambian. En termodinámica, presión, temperatura y volumen están relacionados con la ley de gas de Boyle. Si uno se mantiene constante, los otros cambiarán en proporción entre sí. Si la temperatura de un gas se mantiene constante, la presión y el volumen del gas serán inversamente proporcionales.
Un ejemplo de un proceso isotérmico es un cambio de fase. Cuando una sustancia, como el agua, alcanza su punto de fusión o punto de ebullición, la presión y la temperatura permanecerán constantes a medida que el cambio de fase, volumen y energía térmica.
Los procesos isotérmicos forman la base de los motores de calor que se utilizan en plantas de energía eléctrica, automóviles, aviones, cohetes y otras máquinas que son importantes para la civilización moderna. Los procesos isotérmicos también son importantes en biología, geología, ciencia espacial, ciencias planetarias y muchos otros campos.
¿Qué es isobárico??
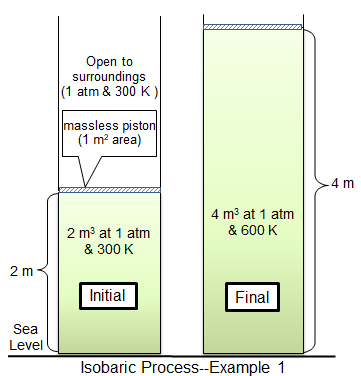
En un proceso isobárico, la presión en un sistema permanece constante. En condiciones isobáricas, el volumen y la temperatura están directamente relacionados. Si la temperatura aumenta, también debe el volumen. Esto se puede ilustrar colocando un globo en un congelador. La presión tanto dentro del globo como por fuera permanecerá constante, pero el globo comenzará a encogerse en volumen a medida que se enfría.
Otro ejemplo es un pistón ponderado que se mueve por gas con calefacción en un cilindro. A medida que el gas se calienta, la temperatura del gas aumenta y el gas se expande, empujando el pistón. Si el pistón fuera arreglado y no pudiera moverse, la presión en el gas aumentaría en lugar de la expansión del gas y el sistema no sería isobárico.
Los procesos isobáricos son importantes en la construcción de motores de calor, ya que ciertos motores de calor dependen de los procesos isobáricos para convertir la energía térmica en energía mecánica.
Similitudes entre adiabatic vs. isotérmico vs. isobárico
Los procesos adiabáticos, isotérmicos e isobáricos están relacionados con la presión, la temperatura y el volumen. También están todos bien ilustrados con gases. Los tres tipos de procesos también son más relevantes en las atmósferas planetarias.
Diferencias entre adiabatic vs. isotérmico vs. isobárico
Aunque estos procesos tienen similitudes, también tienen diferencias importantes. Estos incluyen lo siguiente.
- La temperatura de un gas disminuirá a medida que el gas se expande en un sistema adiabático, mientras que la temperatura permanecerá constante a medida que el gas se expande en un sistema isotérmico y aumente a medida que el gas se expande en un sistema isobárico.
- En un sistema adiabático o isotérmico, el volumen de un gas es inversamente proporcional a la temperatura, mientras que es directamente proporcional a la temperatura en un sistema isobárico.
- La presión de un gas es inversamente proporcional al volumen en un sistema isotérmico, mientras que no cambia en un sistema isobárico, y la presión sobre un gas es inversamente proporcional al volumen en un sistema adiabático.
- El calor no cambia en un sistema adiabático, mientras que cambia en un sistema isotérmico o isobárico.
Adiabatic vs. isotérmico vs. isobárico

Resumen
En un sistema adiabático, no hay un cambio neto en el calor. Cuando un gas se expande, la temperatura disminuirá, lo que conducirá al enfriamiento adiabático. Si se comprime un gas, la temperatura aumentará, lo que llevará al calentamiento adiabático. Los procesos adiabáticos son importantes en la ciencia atmosférica. En un proceso isotérmico, la temperatura es constante, y la presión y el volumen están inversamente relacionados entre sí. Un ejemplo de un proceso isotérmico es un cambio de fase. Durante el cambio de fase, la temperatura de una sustancia no cambiará a pesar de que su calor y volumen cambie. En un sistema isobárico, la presión permanece constante y el volumen aumentará o disminuirá con la temperatura. Si se coloca un volumen de gas en un congelador, por ejemplo, el volumen de gas disminuirá en tamaño ya que la presión es constante mientras su temperatura se cae.

