Diferencia entre la energía de la energía de enlace y la entalpía de energía de disociación de enlaces
- 2438
- 88
- Florencia Galindo
Energía de enlace vs. Energía de disociación de enlaces (entalpía)
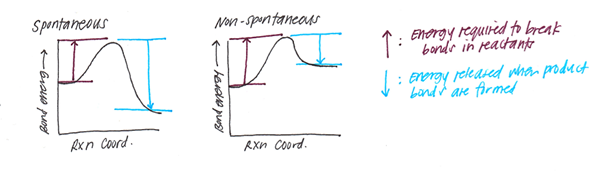
La energía del enlace es el valor promedio de las energías de disociación de enlaces en fase gaseosa (generalmente a una temperatura de 298 K) existente entre los mismos tipos de átomos. Sin embargo, la energía de enlace y la energía de disociación de enlaces no son la misma. La energía de disociación del enlace es el cambio de entalpía estándar cuando un enlace covalente (también denominado un enlace molecular es un enlace químico entre dos átomos no metálicos, que implica el intercambio de pares de electrones entre esos átomos) se escinde por la homólisis (la descomposición a igual piezas) para dar fragmentos; que suelen ser especies radicales. Por lo tanto, la principal diferencia entre la energía de la disociación del enlace y la energía de la disociación es que la energía de enlace es un valor promedio, mientras que la energía de disociación de enlaces es un valor particular para un enlace particular.
¿Qué es la energía de enlace y la energía de disociación de enlaces (entalpía)?
Energía de enlace
La energía de enlace se refiere a la energía que se requiere para descomponer todos los enlaces que existen entre el mismo tipo de especies químicas en un compuesto.
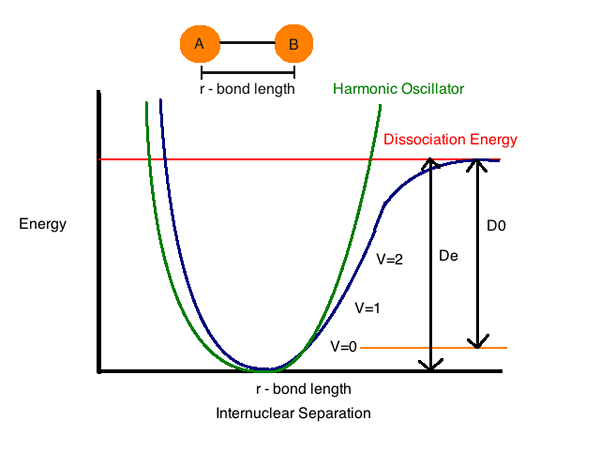
Una parcela de la energía potencial de un sistema de 2 átomos y la distancia entre las especies químicas muestra la distancia a la que la energía es demasiado menor. Esta distancia revelada es la longitud de la unión entre los átomos.
Cuanto mayor sea la energía de enlace (e) vinculada con un par de especies químicas específicas, más fuerte se dice que es el enlace, y menor la distancia entre los 2 átomos.
Energía de disociación de enlaces
Energía de disociación de enlaces (entalpía) (h) es la cantidad de energía requerida para descomponer un enlace particular en la homólisis. Podemos definirlo como el cambio de entalpía que tiene lugar cuando un vínculo se somete a escote por homólisis. La energía de disociación de enlaces es específica de un solo enlace.
La entalpía del enlace, (propiedad termodinámica de un sistema) o energía de disociación de enlaces, se denomina cambio de entalpía estándar cuando un enlace se escinde (separado o dividido) por homolises (descomponiéndose en pedazos pequeños) con reactivos y productos de la reacción de homólisis en 0 K (Absoluto Zero).
Diferencia entre la energía de la disociación de la energía y el enlace (entalpía)
Descripción
Energía de enlace
La energía del enlace también se denomina entalpía de enlace y se define como la medida de la resistencia del enlace en un enlace químico. La energía de enlace es un valor promedio
Energía de disociación de enlaces
La energía de disociación del enlace se define como el cambio de entalpía estándar que se requiere para romper un enlace químico
Producto
Energía de enlace
Bond Energy ofrece la energía necesaria para formar los átomos que son el material de partida para la formación de enlaces.
Energía de disociación de enlaces
Energía de disociación de enlaces siempre que la energía necesaria para formar radicales libres de los átomos que creó ese enlace particular.
Ejemplo
Energía de enlace
En química, la energía de enlace (e) o la entalpía de enlace (h) es la medida de la resistencia al enlace en un enlace químico.... Por ejemplo, la energía de enlace de hidrógeno (C-H) en metano (CH4) es el cambio de entalpía involucrado con la ruptura de una molécula de CH4 en un átomo de carbono (C) y cuatro radicales de hidrógeno (H), dividido por cuatro.
Energía de disociación de enlaces
Por ejemplo, en la molécula de metano, las energías de disociación de enlaces para enlaces C-H son 439 kJ/mol, 460 kJ/mol, 423 kJ/mol y 339 kJ/mol. Sin embargo, la energía de enlace del C-H del metano es 414 kJ/mol, que es el promedio de los cuatro valores. Además, para una molécula, la energía de disociación de enlaces puede no ser necesariamente igual a la energía de enlace (como para el ejemplo de metano anterior). Para una molécula diatómica, la energía de enlace y la energía de disociación de enlaces son la misma.
Símbolo
Energía de enlace
Se denota por e
Energía de disociación de enlaces
Se denota por h
Formación de bonos
Energía de enlace
Da la energía necesaria para formar los átomos que eran el material de partida para la formación de enlaces
Energía de disociación de enlaces
Da la energía requerida para crear radicales libres a partir de los átomos que crearon ese enlace particular
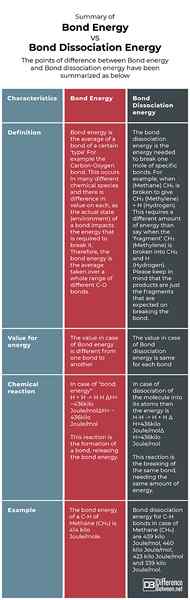
Resumen de la energía de enlace vs. Energía de disociación de enlaces
Los puntos de diferencia entre la energía de enlace y la energía de disociación de enlaces se han resumido como a continuación:
- « Diferencia entre la jurisdicción de la materia y la jurisdicción personal
- Diferencia entre el cambio climático y el agotamiento de ozono »

