Diferencia entre coloid y suspensión
- 4138
- 815
- Pablo Carranza
Los sistemas de dispersión consisten en dos o más compuestos químicos o sustancias simples, llamados componentes del sistema, distribuidos entre sí. Ellos forman:
- Fase dispersa: la sustancia dispersa;
- Medio continuo: la sustancia en la que se distribuye la fase dispersa.
Dependiendo del tamaño de las partículas de la fase dispersa hay:
- Sistemas de dispersión heterogéneos (ásperos): las partículas son mayores de 100 nm:
- Suspensión: un componente líquido y sólido;
- Emulsión: dos componentes líquidos;
- Aerosol: el medio de dispersión es un gas.
- Coloides: el tamaño de las partículas es entre 1 y 100 nm;
- Soluciones reales: el tamaño de partícula es inferior a 1 nm.

Que es coloides?
Soluciones de agua de muchas sustancias (azúcar, etc.), pasan fácilmente a través de barreras semipermeables vegetales o animales, mientras que otros como la gelatina no pasan a través de ellas. Las primeras sustancias se llaman cristaloides, y el segundo se llama coloides.
Dependiendo de cómo las partículas de la fase dispersa se refieran al medio, los sistemas coloides son:
- Liofílico: adsorbe una gran cantidad de moléculas del medio de dispersión (gelatina, jabones, Fe (OH)3, Al (oh)3);
- Liofóbico: no se una ni se una con un pequeño número de moléculas del medio de dispersión (sales de ciertos metales, sulfuros metálicos mal solubles, etc.).
Dependiendo de la estructura de partículas coloides, los sistemas coloides se subdividen en:
- Asociado (micelar): las partículas son grupos de átomos, iones o moléculas (E.gramo. cloruro de sodio en benceno);
- Molecular: las partículas son moléculas de un compuesto que tiene una masa molecular alta (E.gramo. almidón).
Dependiendo de la naturaleza del medio, los coloides son:
- Hidrosoles: el solvente es agua;
- Benzenosoles: el solvente es benceno;
- Etherosoles: el disolvente es etc.
Las propiedades ópticas de los coloides se manifiestan como coloración, opalescencia y efecto tindal. Se deben a diferencias en la absorción y dispersión de la luz de las partículas coloidales.
Las partículas coloidales son más grandes y pesadas que los iones y la mayoría de las moléculas, por lo que su difusión y presión osmótica son bajas.
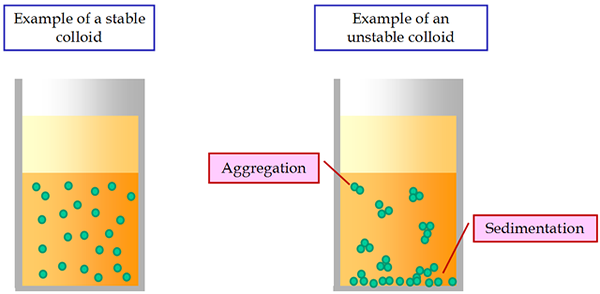
Una propiedad cinética característica de los coloides es el movimiento browniano. Los sistemas coloides son menos estables que los de las soluciones ordinarias. Bajo una corriente eléctrica constante, todas las partículas coloides se mueven al electrodo cargado opuesto correspondiente. Este fenómeno se llama electroforesis.
Los soles de coloides moleculares se obtienen análogos a las soluciones reales. Tras el contacto de la fase dispersa se disuelve espontáneamente en el medio disperso. Los soles de los coloides asociados se obtienen mediante varios métodos de dispersión y condensación.
- Métodos de dispersión: dispersión del material al tamaño de las partículas coloidales en presencia de un medio de dispersión;
- Métodos de condensación: condensación (agrupación) moléculas individuales, átomos o iones en partículas de tamaño coloide.
Que es la suspensión?
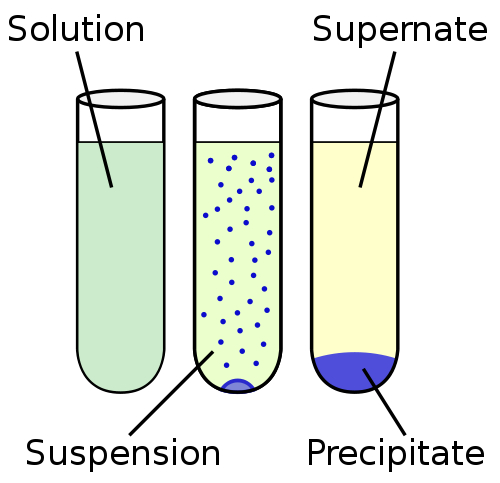
La suspensión es un líquido heterogéneo, que contiene partículas sólidas insolubles que son lo suficientemente grandes como para asentarse, pero durante algún tiempo están presentes durante todo el volumen de la matriz líquida. Las partículas son más grandes de 100 nm.
La clasificación de las suspensiones se basa en la fase dispersa y el medio de dispersión.
La suspensión está más cerca de la insolubilidad en el continuo de solubilidad. En el otro extremo del continuo de solubilidad está la solución, donde las partículas están completamente mezcladas y no se observan fase sólida. El continuo de solubilidad generalmente se organiza en el orden: insolubilidad, sedimentación, suspensión, coloide y solución.
La fase sólida de la suspensión se dispersa en la fase líquida mediante un proceso de agitación mecánica mediante un agente inerte o débilmente activo utilizado como agente suspendido. A diferencia de los coloides, las suspensiones se calman con el tiempo. Un ejemplo de una suspensión que precipitan rápidamente es la arena y el agua.
Una propiedad característica de las suspensiones es su inhomogeneidad óptica, que se expresa por turbidez. La turbidez es un signo externo integral de la suspensión y está determinado por la presencia de partículas insolubles que son impermeables a la luz. El grado de turbidez de las suspensiones es diferente. Está determinado por la concentración de la fase suspendida y el grado de su dispersión (tamaño de partícula).
Una de las características más importantes de las suspensiones es su inestabilidad de sedimentación. Se expresa en el inevitable asentamiento de partículas suspendidas bajo la influencia de la gravedad. Las partículas pueden asentarse por sí mismas, sin pegarse juntas. En este caso hay una estabilidad agregada de la suspensión.
Si las partículas de asentamiento se adhieren bajo la influencia de las fuerzas moleculares de cohesión y forman agregados, entonces hay una inestabilidad agregada de suspensiones. Por lo tanto, las suspensiones sedimentacionalmente inestables pueden ser agregadas estables o inestables.
A veces, al coagular suspensiones, se forman copos grandes que están mal humedecen por el medio de dispersión y flotan a la superficie. Este fenómeno se llama floculación.
La inestabilidad de la sedimentación de las suspensiones en la práctica conduce a una interrupción gradual de la composición uniforme antes de la deposición completa de la fase insoluble.
También hay suspensiones, que tienen la capacidad de permanecer en un estado suspendido durante mucho tiempo. Se llaman suspensiones estables.
Las suspensiones se obtienen mediante varios métodos de dispersión y condensación.
Diferencia entre coloid y suspensión
-
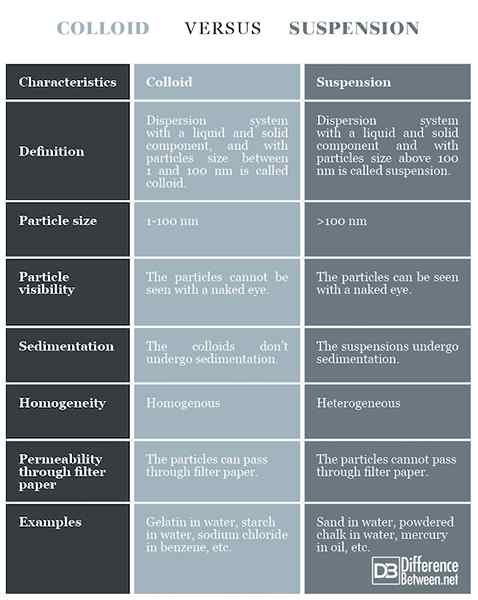
Definición
Coloide: El sistema de dispersión con un componente líquido y sólido, con un tamaño de partículas entre 1 y 100 nm se llama coloide.
Suspensión: Sistema de dispersión con un componente líquido y sólido, con un tamaño de partículas por encima de 100 nm se llama suspensión.
-
Tamaño de partícula
Coloide: El tamaño de partícula es de 1 a 100 nm.
Suspensión: El tamaño de partícula es superior a 100 nm.
-
Visibilidad de partículas
Coloide: Las partículas en el coloid no se pueden ver a simple vista.
Suspensión: Las partículas en la suspensión se pueden ver a simple vista.
-
Sedimentación
Coloide: Los coloides no se someten a sedimentación.
Suspensión: Las suspensiones sufren sedimentación.
-
Homogeneidad
Coloide: Los coloides son relativamente homogéneos.
Suspensión: Las suspensiones son heterogéneas.
-
Permeabilidad a través de papel de filtro
Coloide: Las partículas coloides pueden pasar a través del papel de filtro.
Suspensión: Las partículas de suspensión no pueden pasar a través del papel de filtro.
-
Ejemplos
Coloide: Gelatina en agua, almidón en agua, cloruro de sodio en benceno, etc.
Suspensión: Arena en agua, tiza en polvo en agua, mercurio en aceite, etc.
Gráfico de comparación coloide y de suspensión
Resumen de coloides y suspensión
- Los sistemas de dispersión consisten en dos o más compuestos químicos o sustancias simples, llamados componentes del sistema, distribuidos entre sí. Forman una fase dispersa y un medio continuo.
- El sistema de dispersión con un componente líquido y sólido, con un tamaño de partículas entre 1 y 100 nm se llama coloide.
- Sistema de dispersión con un componente líquido y sólido, con un tamaño de partículas por encima de 100 nm se llama suspensión.
- Las partículas en el coloid no se pueden ver a simple vista, mientras que las partículas en la suspensión se pueden ver a simple vista.
- Los coloides no sufren sedimentación, mientras que las suspensiones sufren sedimentación.
- Los coloides son relativamente homogéneos, mientras que las suspensiones son heterogéneas.
- Las partículas coloides pueden pasar a través del papel de filtro, mientras que las partículas de las suspensiones no pueden.
- Ejemplos de coloides son gelatina en agua, almidón en agua, cloruro de sodio en benceno, etc. Ejemplos de suspensiones son arena en agua, tiza en polvo en agua, mercurio en aceite, etc.

