Diferencia entre el punto final y el punto de equivalencia
- 3752
- 645
- Teresa Sánchez
El punto final y el punto de equivalencia son los dos conceptos más importantes en las titulaciones de química. La técnica de titulaciones puede ocurrir en reacciones redox, reacciones ácido-base y muchas más reacciones. Se usa predominantemente en reacciones ácido-base donde implica la neutralización de otra solución con la otra para determinar la concentración desconocida. Básicamente, una solución estándar con concentración conocida se verta cuidadosamente en otra solución llamada analito con concentración desconocida para calcular su concentración.
Durante el proceso de titulación, hay dos etapas que se alcanzan, a saber. punto final y punto de equivalencia. El punto de equivalencia, también llamado punto estequiométrico, en pocas palabras, es un punto donde los moles de las dos soluciones, ácido y base, son equivalentes o iguales. La etapa ocurre antes del punto final, que señala la finalización de la reacción. En algunas reacciones, podría haber numerosos puntos de equivalencia, especialmente en ácidos y bases polipróticas donde existen múltiples iones de hidróxido.
Este artículo desarrolla la diferencia clave entre el punto final y el punto de equivalencia en las titulaciones químicas.

Definición de punto de equivalencia
El punto de equivalencia en la titulación ácida-base señala la finalización de la reacción donde el número de moles del titizante y el analito son iguales como en la ecuación química. Por ejemplo, en una titulación de NaOH y HCl, 1 mol de HCl será igual a exactamente 1 mol de NaOH en el punto de equivalencia. Este punto debe lograrse con precisión administrando una serie de gotas de la solución estándar a la concentración desconocida. Por lo general, se usa una pipeta para verter gotas del titizante en el matraz de medición donde el analito se ha vertido con un cierto indicador. Los indicadores son importantes en las valoraciones de la base ácida para ver claramente la equivalencia y los puntos finales.
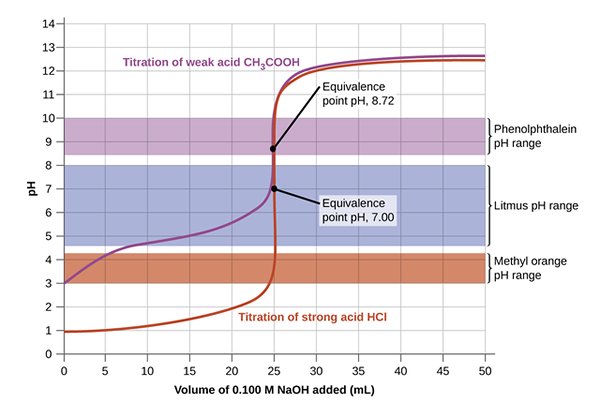
La titulación de ácido y base puede ocurrir entre una base fuerte y una base débil; base fuerte y ácido débil; base fuerte y base fuerte; o ácidos polipróticos débiles. Se puede usar un indicador diferente dependiendo de la solución típica que se usa para la titulación. Por ejemplo, en una valoración de NaOH y HCL, se usa una fenolftaleína, mientras que en NH3 y HCL Un indicador de metilo de naranja es más adecuado para efectuar cambios. Si el pH del titizante corresponde con el pH en el punto de equivalencia, el punto final y el punto de equivalencia pueden ocurrir simultáneamente.
La siguiente imagen ofrece una comprensión clara de la titulación configurada para alcanzar el punto de equivalencia y luego llegar al punto final cuando cambia el color. Al principio, la solución con la concentración desconocida se vierte con el indicador. Luego se agrega el titulador usando la burette controlando las gotas con la válvula. La ecuación mácidoVácido = MbaseVbase se usa para calcular la concentración desconocida por manipulaciones algebraicas que señalan que la molaridad es una serie de lunares por litro.
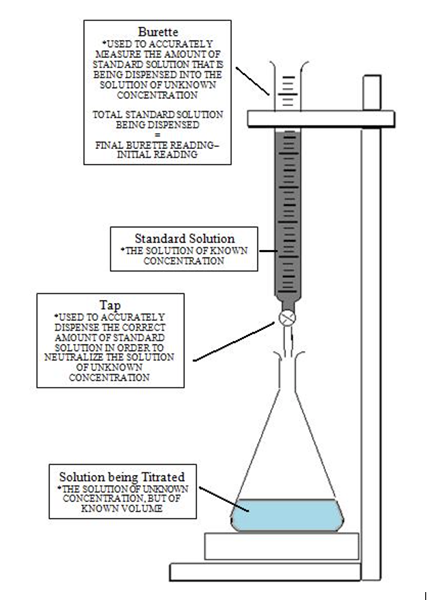
Definición de punto final
El punto final se produce después del punto de equivalencia en titulaciones. Indica que se ha logrado el punto de equivalencia. Este punto final está indicado por el cambio en el color de la solución. Vea la imagen a continuación:

Imagen cortesía: Libretos de química
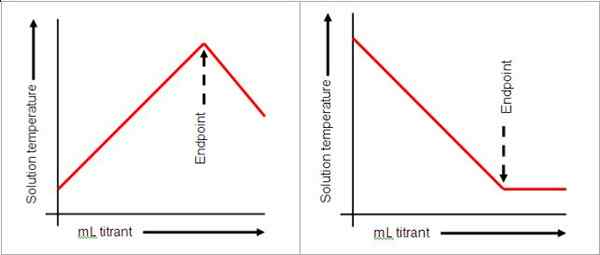
Para llegar al punto final, la cantidad de gotas debe administrarse cuidadosamente porque una sola gota puede cambiar el pH de la solución. En la situación en la que se ha pasado el punto final, se puede realizar una titulación o titulación inversa dependiendo de la naturaleza de la solución. Si se ha vertido demasiado del titulador, el punto final podría pasarse. La solución será agregar otra solución de un reactivo diferente en exceso.
Los indicadores no siempre se usan en titulaciones. Los medidores de pH se pueden usar para leer el pH como una indicación de que la reacción está completa. En una base fuerte y ácido, un pH de 7 indica que la reacción es completa. Sin embargo, el cambio de color es una forma conveniente de monitorear el punto final, por lo tanto, los indicadores a menudo se usan. Una solución de cloruro de sodio y ácido clorhídrico alcanza el punto final como lo indica la fenolftaleína cuando la solución se vuelve rosa. El punto final no indica necesariamente el final de la reacción, sino la finalización de la titulación.
Diferencia entre el punto final y la equivalencia
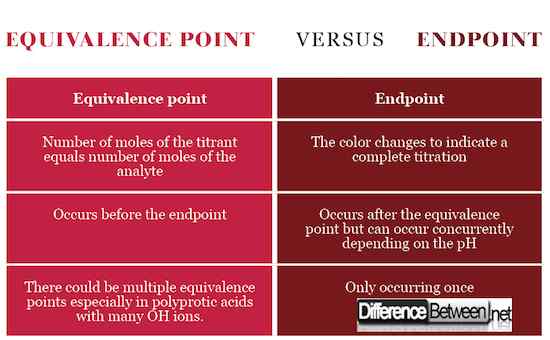
Definición de punto final y equivalencia
El punto final es la etapa de titulación indicada por un cambio de color como un signo de que la titulación está completa y el punto de equivalencia se ha logrado. El punto de equivalencia, por otro lado, es la etapa justo antes del punto final que indica el punto estequiométrico con igual número de moles entre el analito y el titulador en línea con la ecuación química. Para alcanzar el punto de equivalencia, el titulador debe vertirse con precisión y precisamente caída de gota usando el burette.
Ocurrencia de punto final y equivalencia
El punto de equivalencia ocurre cuando el número de moles del titulador, la solución estándar, es igual al número de moles del analito, la solución con concentración desconocida. El punto final ocurre cuando el cambio de color.
Significado de punto final y equivalencia
El punto de equivalencia significa que el titulador ha reaccionado completamente con el analito, mientras que el punto final señala la finalización de la titulación. El punto final y la equivalencia pueden ocurrir al mismo tiempo si el pH del titizante corresponde al pH en el punto de equivalencia.
Versos de punto final equivalencia: tabla de comparación
Resumen de la equivalencia de versos de punto final
- El punto final y el punto de equivalencia son las etapas más importantes en las titulaciones químicas
- El punto final ocurre después del punto de equivalencia e indica la finalización de la titulación, pero no siempre el final de la reacción.
- El punto de equivalencia ocurre antes del punto final e indica la reacción completa entre el titulante y el analito donde el número de moles del titulante es igual al número de moles de la concentración desconocida
- Se alcanza el punto final cuando el color cambia si se ha utilizado el indicador
- Otros ácidos débiles pueden tener múltiples puntos de equivalencia pero solo un punto final
- El punto de equivalencia también se llama punto estequiométrico

