Diferencia entre las células galvánicas y las células electrolíticas
- 1324
- 393
- Florencia Galindo
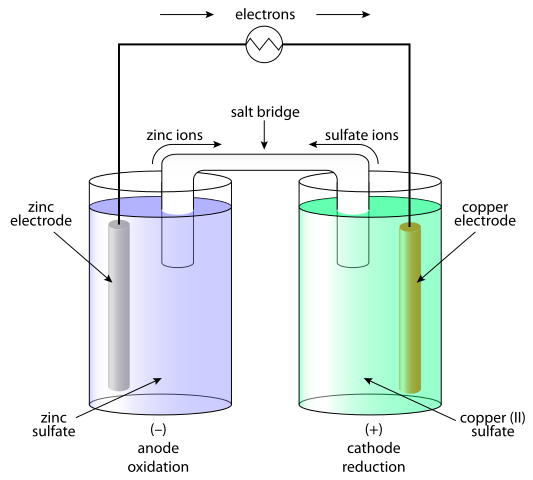
Hay dos tipos de células electroquímicas: células galvánicas, con procesos redox espontáneos que permiten un flujo continuo de electrones a través del conductor, por lo que la energía química se transforma en uno eléctrico; y electrolítico, donde las reacciones redox están influenciadas por una fuente externa de corriente, donde la electricidad se convierte en energía química.

¿Qué es la célula galvánica??
Las células galvánicas son sistemas en los que la energía química se transforma en electricidad y, como resultado, se genera corriente. En las células galvánicas, la corriente continua se genera como resultado del proceso redox (reducción de oxidación). El elemento galvánico consta de dos medias células. La media célula consiste en el electrolito y el electrodo inmerso en él. Entre estas medias células se debe proporcionar un contacto, conectando el electrolito con un puente de sal o una membrana semi-conductiva y conectando el electrodo con conductor. La separación del proceso redox se explica por el comportamiento de los electrodos en relación con el electrolito. La opción más simple es que la media célula está formada por un electrodo metálico sumergido en un corresponsal de iones que contiene electrolitos con el electrodo. El comportamiento de los metales en el electrolito depende de la reactividad del metal i.mi. su tendencia a disolver.
¿Qué es la célula electrolítica??
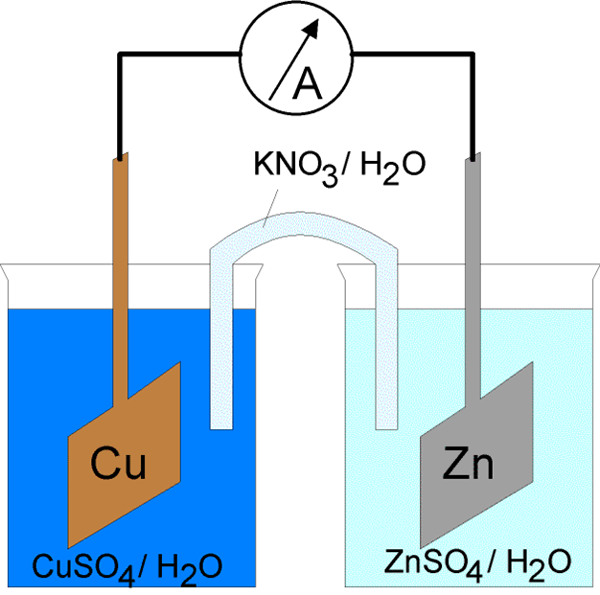
La corriente eléctrica a través de la célula electroquímica se puede iniciar de dos maneras. El primero es conectar electrodos con un conductor en un circuito eléctrico cerrado. Al cerrar el circuito eléctrico, es posible inducir espontáneamente las reacciones de los electrodos en ambas fases del metal/electrolito. Además, la energía de la corriente se libera a expensas de la energía de una reacción química espontánea. Una célula que funciona de esta manera se llama célula galvánica. Esto se explicó arriba. Otra forma es cerrar el circuito eléctrico mediante la unión en serie de una fuente externa de corriente en lugar del voltaje de la celda, en el que el voltaje externo es mayor que la fuerza electromotriz de la celda. Conduce la corriente en dirección opuesta desde la dirección de su flujo espontáneo a través de la celda. Debido a esto, las reacciones de los electrodos en la célula tienen que ser contrarios a la dirección de su flujo espontáneo. Los procesos forzados en una célula electroquímica bajo la influencia de una fuente externa de corriente eléctrica se denominan electrólisis, y la celda electroquímica en tal modo de operación se llama celda electrolítica.
Diferencia entre la célula galvánica y electrolítica
-
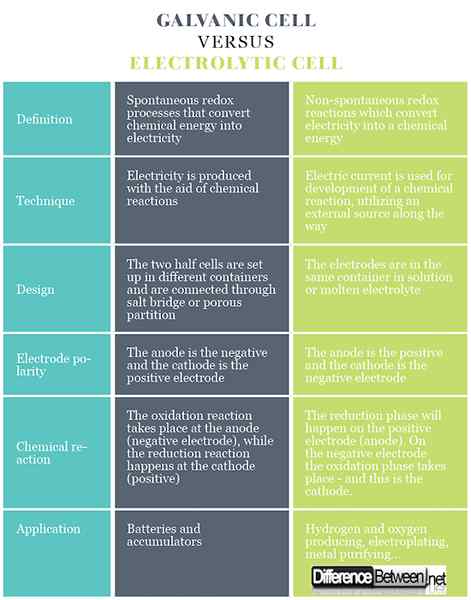
Definición de células galvánicas y electrolíticas
En las células galvánicas hay procesos redox espontáneos que permiten un flujo continuo de electrones a través del conductor, mediante el cual la energía química se convierte en electricidad. En una célula electrolítica, las reacciones redox tienen lugar bajo la influencia de una fuente externa, donde la electricidad se convierte en una energía química. Las reacciones redox no son espontáneas.
-
Técnica de células galvánicas y electrolíticas
Las células galvánicas generan electricidad con la ayuda de reacciones químicas. En las células electrolíticas, se usa una corriente eléctrica para el desarrollo de una reacción química, utilizando una fuente externa en el camino.
-
Diseño de células galvánicas y electrolíticas
Las células galvánicas consisten en dos electrodos diferentes inmersos en soluciones de sus iones que están separados por una membrana semipermeable o un puente de sal. Las células electrolíticas consisten en un recipiente electrolítico en el que dos electrodos están conectados a una fuente de DC. El electrolito puede ser una fusión o una solución acuosa de algo de sal, ácido o álcali.
-
Polaridad de electrodos en célula galvánica y electrolítica
En las células galvánicas, el ánodo es negativo y el cátodo es el electrodo positivo. En las células electrolíticas, ocurre lo contrario.
-
Reacción química en células galvánicas y electrolíticas
En el caso de la célula galvánica, la reacción de oxidación tiene lugar en el ánodo (electrodo negativo) donde hay un excedente de carga negativa. En el cátodo, la reacción de reducción ocurre, induciendo una acumulación positiva de carga. En el caso de la célula electrolítica, se utiliza una fuente exterior para desencadenar una reacción. En el electrodo negativo, los electrones se salen de él, por lo que la fase de reducción ocurrirá en el electrodo negativo. En el electrodo positivo tiene lugar la fase de oxidación, y este es el ánodo.
-
Aplicación de células galvánicas y electrolíticas
Las células galvánicas se utilizan como fuente de corriente eléctrica, y se conocen más comúnmente como baterías o acumuladores. Las células electrolíticas tienen diferentes usos prácticos, algunas de ellas están haciendo gas de hidrógeno y oxígeno para aplicaciones comerciales e industriales, electroplacas, extrayendo metales puros de aleaciones, etc.
Galvánico vs. Célula electrolítica: comparación en forma tabular
Resumen de Galvanic vs. Célula electrolítica
- Una célula electroquímica está compuesta por dos medias células o electrodos cuyo contacto se realiza a través de un electrolito (conductor iónico). Las medias células, si están separadas, pueden unirse por un puente de sal (solución concentrada de electrolitos en gel de agar-agar). La célula galvánica produce corriente eléctrica basada en un cambio químico que ocurre espontáneamente en ella. La célula electrolítica hace exactamente lo contrario: la corriente da como resultado un cambio químico. Para que la célula sea galvánica, debe ocurrir un cambio químico espontáneo en ella.

