Diferencia entre la unión iónica y covalente
- 4894
- 687
- Miguel Arias
 Enlace iónico vs covalente
Enlace iónico vs covalente
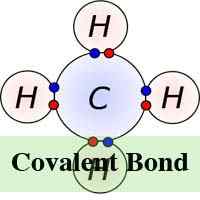
En química, se forma una molécula y un compuesto cuando dos o más átomos se conectan entre sí a través de un proceso químico conocido como enlace. Hay dos tipos de unión química "covalente e iónico. En la forma iónica de unión química, los átomos que están unidos juntos, lo hacen atrayendo iones que tienen la carga opuesta y el número de electrones que se intercambian en el proceso pueden variar. Sin embargo, en la unión química, los átomos comparten electrones.
En la unión iónica, los electrones se transfieren totalmente de uno de los átomos de unión al otro. Son las fuerzas electrostáticas las que hacen que los iones con carga opuesta se sientan atraídas entre sí. Por ejemplo, en una unión iónica entre sodio y cloro, el sodio pierde su único electrón que se carga positivamente al ion cargado negativamente de cloro. En la unión iónica, el átomo pierde su electrones se encoge y el átomo ganando electrones crece en tamaño. Esto no es así en la unión covalente en la que los iones se comparten por igual. La unión covalente tiene lugar cuando ocurre los átomos porque los átomos en el compuesto tienen una capacidad similar para ganar y perder iones. Por lo tanto, los enlaces iónicos pueden formarse entre metales y no metales, mientras que los enlaces covalentes se forman entre dos no metales.
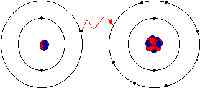 Los enlaces iónicos también se pueden disolver en agua y otros tipos de solventes polares. Además, los compuestos iónicos son muy buenos conductores de electricidad. Los enlaces iónicos también conducen a la formación de sólidos cristalinos con una alta temperatura de fusión. Los compuestos iónicos también son siempre sólidos.
Los enlaces iónicos también se pueden disolver en agua y otros tipos de solventes polares. Además, los compuestos iónicos son muy buenos conductores de electricidad. Los enlaces iónicos también conducen a la formación de sólidos cristalinos con una alta temperatura de fusión. Los compuestos iónicos también son siempre sólidos.
Mientras tanto, a diferencia de la unión iónica, la unión covalente requiere que las moléculas existan en su forma verdadera y, por lo tanto, las moléculas covalentes no se atraen entre sí, sino que existen libremente en líquidos o gases a temperatura ambiente. La unión covalente también puede conducir a una unión múltiple a diferencia de la unión iónica. Esto se debe a que algunos átomos tienen la capacidad de compartir múltiples pares de electrones, formando así múltiples enlaces covalentes al mismo tiempo.

