Diferencia entre nitrificación y desnitrificación
- 2425
- 414
- María Elena Elizondo

Nitrificación
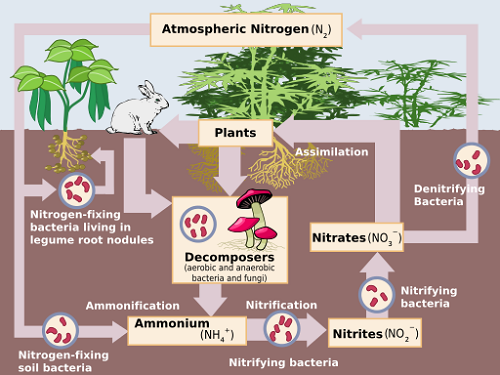
La nitrificación es la transformación biológica del amonio (NH4+) al nitrato (no3-) por oxidación. La oxidación se define como la pérdida de electrones por un átomo o compuesto, o un aumento en su estado de oxidación. El proceso es facilitado por dos tipos de bacterias aeróbicas nitrificantes que requieren la presencia de moléculas de oxígeno disueltas en su entorno, para sobrevivir. [i]
Primero, bacterias quimioterróficas (principalmente las del género Nitrosomonas) convertir amoníaco (NH3) y amonio a nitrito (no2-). "Chemoautrófico" se refiere a la capacidad de las bacterias para crear sus propios nutrientes a partir de una fuente inorgánica, a saber2. El proceso está representado por la ecuación química:
2NH4+ + 3O2 → 2NO2- + 2h2O + 4H+ + energía
Luego bacterias principalmente de la Nitrobacero Grupo convertir nitrito a nitrato en la siguiente reacción:
22- + O2 → 2NO3- + energía
Estas reacciones tienen lugar simultáneamente y bastante rápido, generalmente en días o semanas. Es importante que el nitrito se convierta completamente en nitrato en suelos, ya que el nitrito es tóxico para la vida vegetal.
Los nitratos presentes en el suelo son la principal fuente de nitrógeno utilizada por las plantas. [ii] Por lo tanto, la transición de nitrógeno de una forma a otra, conocida como ciclo de nitrógeno, es una parte importante de la industria agrícola.[iii]
Antes de que se produzcan estos pasos, la hidrólisis se descompone el nitrógeno orgánico por la hidrólisis para formar amonio y amoníaco en un proceso conocido como amonificación. i El amoníaco se puede encontrar en la urea de desechos de animales, compost y descomposición de cultivos de cobertura o residuos de cultivos. El amonio se encuentra en la mayoría de los fertilizantes.
Las bacterias nitrificantes son más sensibles a las tensiones ambientales que otros tipos de bacterias del suelo. Cuando el suelo ha sido saturado de humedad durante períodos prolongados, los poros del suelo se llenan de agua, lo que limita el suministro de oxígeno. Las bacterias nitrificantes requieren condiciones aeróbicas para que funcionen, por lo tanto, las inundaciones restringen la nitrificación.
Los suelos secos tienden a tener una alta concentración de sal y la salinidad resultante afecta negativamente la actividad nitrificante de las bacterias. Esto se debe a que el aumento de la osmolaridad aumenta la cantidad de energía requerida por los microorganismos para mover agua a través de sus membranas celulares. El agua también es esencial para el movimiento de solutos, como los nitratos, a través del suelo. II
Las bacterias nitrificantes funcionan mejor a un pH entre 6.5 y 8.5 y temperaturas entre 16 y 35 grados C. i Las tasas de nitrificación son más lentas en suelos muy ácidos, mientras que la alta alcalinidad se reduce Nitrobacero actividad, causando una acumulación desfavorable de nitrito en el suelo.
El pH del suelo también puede verse afectado por la fuente particular de amonio nitrificado. Por ejemplo, la solución de fosfato de monoamonio (MAP) es mucho más ácido que el fosfato de diamonio (DAP); Por lo tanto, el uso de DAP da como resultado tasas de nitrificación más altas que el mapa.
La mayoría de las bacterias se encuentran en la capa superficial superior, por lo que la nitrificación disminuye cuando las prácticas de labranza no se manejan adecuadamente.
Los suelos con alto contenido de arcilla tienen partículas más grandes y más espacio de microporos para el crecimiento bacteriano, así como una mayor retención de amonio debido a una mayor capacidad de intercambio de cationes. II Las relaciones con el agua y las propiedades físicas del suelo pueden mejorarse mediante el cultivo de la labranza reducida.
La nitrificación puede ser inhibida por la presencia de metales pesados y compuestos tóxicos, o concentraciones excesivamente altas de amoníaco.
A veces puede ser beneficioso mantener el nitrógeno en el suelo en forma de amonio. Esto evita la pérdida de nitrógeno (mediante la lixiviación de nitratos) y el escape de gas nitrógeno (a través de la desnitrificación). Los inhibidores de nitrificación utilizados incluyen comercialmente dicyandiamida y nitrapirina.
Desnitrificación
La desnitrificación es la transformación biológica del nitrato a los gases nitrogenados por reducción. Siempre sigue la nitrificación i y la secuencia de reacción puede representarse de la siguiente manera:
NO3- → No2- → No → N2O → N2[iv]
El proceso es facilitado por bacterias facultativas; Estas son bacterias que no requieren la presencia de oxígeno libre para la respiración. Las bacterias desnitrificantes son organismos heterotróficos, ya que necesitan una fuente de alimento orgánico, en forma de carbono, para sobrevivir. La desnitrificación puede comenzar tan rápido como minutos después de la estimulación del proceso.
La desnitrificación puede ser perjudicial para la producción de cultivos, ya que el nitrógeno, un nutriente esencial para el crecimiento de las plantas, se pierde en la atmósfera durante el proceso. Sin embargo, es beneficioso para los hábitats acuáticos y en el tratamiento de aguas residuales industriales o de aguas residuales, ya que la concentración de nitrato en el agua se reduce. i
La lixiviación o escorrentía de los cultivos debido a los tratamientos de fertilizantes puede causar que las cantidades excesivas de este nutriente terminen en los cuerpos de agua, donde los compuestos nitrogenados tienen varios efectos nocivos en la vida humana y acuática. IV
El amoníaco es tóxico para las especies de peces y estimula el crecimiento de las algas, reduce los niveles de oxígeno en el agua y da como resultado la eutrofización. Los nitratos causan daño hepático, cánceres y metemoglobinemia (deficiencia de oxígeno en lactantes), mientras que los nitritos reaccionan con compuestos orgánicos llamados aminas para formar nitrosaminas carcinogénicas. II
Cuando los niveles de oxígeno en suelos o agua se agotan (condiciones anóxicas), las bacterias desnitrificantes descomponen los nitratos para su uso como fuente de oxígeno. Esto ocurre comúnmente en suelos anegados donde los niveles de oxígeno son bajos. El nitrato se reduce a óxido nitroso (N2O) y una vez más al gas nitrogenado. Estas burbujas de gas escapan a la atmósfera. i
El gas formado por los denitrificadores depende de las condiciones en el suelo o el agua y qué tipo de comunidad microbiana está presente. Menos oxígeno tiende a dar como resultado más gases de nitrógeno, el producto más común de la desnitrificación. El gas nitrógeno forma el componente principal del aire. El segundo producto más común formado es el óxido nitroso, un gas de efecto invernadero que también erosiona la capa de ozono de la Tierra. IV
Las bacterias desnitrificantes son menos sensibles a los químicos tóxicos que los nitrificadores y funcionan de manera óptima a un pH entre 7.0 y 8.5 y temperaturas más cálidas entre 26 y 38 grados C. La desnitrificación ocurre principalmente en la capa superficial del suelo, donde la actividad microbiana es más alta.
Los denitrificadores requieren suficiente concentración de nitrato y una fuente de carbono soluble; Las tasas más altas ocurren al usar metanol o ácido acético. Se puede encontrar carbono orgánico en estiércol, compost, cultivos y residuos de cultivos. i
La minimización de la desnitrificación en los suelos de cultivo se logra manteniendo la concentración mínima de nitrato necesaria para el crecimiento de la planta, como el uso de fertilizantes de liberación controlada. Otro método es inhibir la nitrificación, lo que reduce los niveles de nitrato disponibles para la desnitrificación.
Los niveles de desnitrificación varían ampliamente en un solo campo, debido a muchos factores, como las propiedades del suelo (incluida la agregación, los macroporos y la humedad) y las variaciones en la distribución de fertilizantes, materia orgánica y residuos de cultivos.
Se ha informado que los tipos de fertilizantes de nitrógeno, así como los métodos de aplicación, afectan la desnitrificación. Por ejemplo, los fertilizantes de liberación controlada recubierta, así como las aplicaciones de fertigación y transmisión, causan emisiones más bajas de óxido nitroso que las aplicaciones de orea granular seca y la banda concentrada. La colocación más profunda de nitrógeno también disminuye estas emisiones.
Los períodos secos seguidos de una tormenta repentina son a menudo un desencadenante de la desnitrificación, que se puede gestionar con sistemas de drenaje y riego por goteo subterráneo. IV
Resumen
Nitrificación
- Sigue el proceso de amonificación
- Transformación de amonio a nitrato
- Reacción de oxidación
- Facilitado por dos tipos principales de bacterias aeróbicas quimioautróficas: Nitrosomonas y Nitrobacero
- Proceso de dos pasos: conversión de amonio a nitrito, luego conversión de nitrito a nitrato
- Crea una forma de nutrientes de nitrógeno disponible para la absorción por raíces vegetales
- Reactante (amonio) encontrado en urea de desechos de animales y fertilizantes, compost y descomposición de cultivos de cobertura o residuos de cultivos
- Nitrificadores más sensibles a la tensión ambiental
- Inhibido por las inundaciones, la alta salinidad, la alta acidez, la alta alcalinidad, la labranza excesiva y los compuestos tóxicos
- Favorecido por condiciones aeróbicas, pH entre 6.5 y 8.5, temperaturas entre 16 y 35 grados C y alto contenido de arcilla
Desnitrificación
- Sigue el proceso de nitrificación
- Transformación de nitrato a gases nitrogenados, principalmente nitrógeno y óxido nitroso
- Reacción de reducción
- Facilitado por bacterias facultativas heterotróficas
- Secuencia de pasos: conversión de nitrato a nitrito, óxido nítrico, óxido nitroso y finalmente a nitrógeno
- Descontamina los sistemas de aguas residuales y acuáticas reduciendo los niveles de nitrato
- Reactante (nitrato) formado por nitrificación, mientras que las fuentes de carbono para los denitrificadores se encuentran en el estiércol, los cultivos y los residuos de cultivos, o se proporcionan por metanol o ácido acético
- Denitrificadores menos sensibles a la tensión ambiental
- Inhibido por nitrificación reducida, niveles bajos de nitrato, colocación profunda de fertilizante de liberación controlada recubierta y drenaje del suelo
Favorecido por inundaciones, condiciones anóxicas, pH entre 7.0 y 8.5, temperaturas entre 26 y 38 grados C, suministro suficiente de nitratos y carbono soluble y aplicaciones de banda concentrada de urea granular seca.
- « Diferencias entre la energía del carbón y la energía nuclear
- Diferencia entre el calor específico y la capacidad de calor »

