Diferencia entre la presión parcial y la presión de vapor
- 1272
- 317
- Miguel Arias
La presión parcial y la presión de vapor se utilizan comúnmente términos científicos relacionados con la cantidad de presión ejercida por los componentes del sistema, pero su identidad puede ser confuso para los demás. Existe una clara distinción entre estos términos, incluidos sus efectos e identidad. Este artículo explicará más sobre las diferencias entre estos términos. También incluirá algunos ejemplos para desmitificar las aplicaciones de las mismas.
Comencemos resaltando el concepto de presión antes de que podamos profundizar en la distinción entre vapor y presión parcial. La presión se define científicamente como la fuerza aplicada por unidad de área en un objeto o una sustancia. También se puede definir como la fuerza aplicada por las partículas colisionadas entre sí y a menudo se mide usando Pascal. En el caso de la colisión de partículas, la ecuación de gas y la teoría cinética de los gases se usa para calcular la presión.

¿Qué es la presión de vapor??
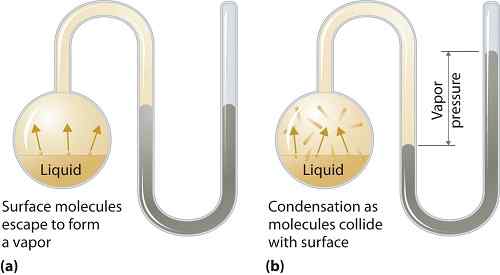
La presión de vapor puede aplicarse a las fases líquidas o sólidas. Es la presión ejercida por el vapor en su equilibrio termodinámico en su estado líquido o sólido a una temperatura dada en un sistema cerrado cuando tanto el vapor como el líquido (sólido) están en contacto. Esta presión surge como resultado de la vaporización, que está habilitada por un mayor calor en el sólido o líquido. Por lo tanto, la temperatura se usa como medida de vaporización y es directamente proporcional a la presión de vapor. Esto significa que cuanto mayor es la temperatura, mayor es la presión de vapor.
Durante la vaporización, las moléculas de aire escapan como resultado de la mayor energía cinética al aire en un sistema cerrado. Luego, cuando está en equilibrio, la presión de vapor surge entre el vapor y su forma condensada de líquido (sólido). En soluciones donde las fuerzas intermoleculares son más débiles, la presión de vapor tiende a ser más y, por el contrario, en soluciones donde las fuerzas intermoleculares son más fuertes, la presión de vapor es menos.
La presión de vapor también puede ocurrir en mezclas ideales como lo explican la ley de Raoult. Establece que la presión de vapor parcial de un componente particular en una mezcla líquida o sólida es igual a la presión de vapor de ese componente multiplicado por su fracción moles en esa mezcla a una temperatura dada. El siguiente ejemplo ilustrará que.
Ejemplo 1.
Dada una mezcla ideal de 0.5 moles. etanol y 1.5 moles. metanol con la presión de vapor de 30kPa y 52kPa, respectivamente, determine la presión de vapor parcial de cada componente.
Solución:
El número total de lunares es 1.5mol + 0.5mol = 2.0mol. Según la ley de Raoult, la presión parcial de vapor es igual a la presión de vapor multiplicada por la fracción molar de ese componente particular. En este caso, el Pmetanol = 1.5/2 * 52 = 39KPA y Petanol = 0.5/2 * 30 = 7.5kpa.
Cuando tiene las presiones parciales de vapor de los componentes en la mezcla, puede obtener la presión total de vapor agregándolas. En este sentido, 7.5 + 39 da 46.Presión total de vapor de 5 kPa de la mezcla de soluciones de etanol y metanol.
Factores que afectan la presión de vapor
Identidad de moléculas
Como ya se mencionó anteriormente, los tipos de fuerzas moleculares determinan la cantidad de presión de vapor a ejercer. Si las fuerzas son más fuertes, entonces surge menos presión de vapor, y si es más débil, entonces surge más presión de vapor. Por lo tanto, la composición del líquido o el sólido afectará la presión de vapor.
Temperatura
Una temperatura más alta conduce a una mayor presión de vapor porque activa más energía cinética para romper las fuerzas moleculares para que las moléculas puedan escapar de la superficie líquida rápidamente. Cuando la presión de vapor (presión de vapor saturada) es igual a la presión externa (presión atmosférica), el líquido comenzará a hervir. Una temperatura más baja dará como resultado una baja presión de vapor y el líquido tardará en hervir.

Ley de presiones parciales de Dalton
¿Qué es la presión parcial??
La idea de presión parcial fue propuesta por primera vez por el reconocido científico John Dalton. Dio a luz a su ley de presiones parciales que establece que la presión total ejercida por una mezcla ideal de gases es igual a la suma de las presiones parciales de los gases individuales. Digamos que un recipiente en particular está lleno de gases de hidrógeno, nitrógeno y oxígeno, la presión total, PTOTAL, será igual a la suma de oxígeno, nitrógeno e hidrógeno. La presión parcial de cualquier gas en esa mezcla se calcula multiplicando la presión total por la fracción molar del gas individual.
En pocas palabras, la presión parcial es la presión ejercida por un gas particular en la mezcla como si actuara solo en el sistema. Por lo tanto, ignora otros gases al determinar la presión parcial de un gas individual. Esta teoría se puede verificar inyectando, digamos, 0.6atm de o2 en un 10.Container 0 L a 230k y luego inyectar 0.4atm n2 en un contenedor idéntico del mismo tamaño a la misma temperatura, y luego combina los gases para medir la presión total; será la suma de los dos gases. Esto explica claramente la presión parcial de un gas individual en una mezcla de gases no reactivos.
Calcular la presión parcial
Calcular la presión parcial es una brisa absoluta ya que la ley de Dalton [1] proporciona disposiciones para eso. Dependerá de la información típica proporcionada. Si, por ejemplo, la presión total se da para una mezcla de gas A y B, así como la presión del gas A, la presión parcial de B se puede calcular usando PTOTAL = PA + PAGB. El resto son manipulaciones algebraicas. Pero en un caso en el que solo se ha dado la presión total de la mezcla, puede usar la fracción molar del gas B para determinar la presión parcial. La fracción molar, denotada por x, se puede encontrar dividiendo los moles de gas B por los moles totales de la mezcla de gases. Luego, para encontrar la presión parcial, multiplicará la fracción molar, x, por la presión total. El ejemplo a continuación elabora que.
Ejemplo 2.
Una mezcla de nitrógeno y oxígeno, con 2.5 moles y 1.85 moles, respectivamente, se inyectan en 20.0L contenedor con una presión total de 4ATM; Calcule la presión parcial ejercida por el gas oxígeno.
Solución:
El número total de moles en la mezcla es 2.5 + 1.85 = 4.35 moles. Entonces la fracción molar del oxígeno, xO, será 1.85 moles/4.35 moles = 0.425 moles. La presión parcial del oxígeno será 0.425 * 4ATM = 1.7atm. La presión parcial del gas restante se puede calcular siguiendo el mismo enfoque o se puede calcular utilizando el gas de oxígeno y la presión total elaborada por la ley de presiones parciales de Dalton de que la presión total de gases no reactivos es igual a la suma de las presiones parciales.
Diferencia entre vapor y presión parcial
De las explicaciones anteriores, es evidente que la presión del vapor y la presión parcial son dos presiones distintas. La presión de vapor se aplica en las fases líquidas y sólidas, mientras que la presión parcial se aplica en la fase gaseosa. La presión de vapor se ejerce en la transición de fase después de que se haya agregado suficiente calor a la solución, lo que lleva a sus moléculas para escapar en un sistema cerrado.
La principal diferencia entre la presión parcial y la presión del vapor es que la presión parcial es la presión ejercida por un gas individual en una mezcla como si estuviera solo en ese sistema, mientras que la presión de vapor se refiere a la presión ejercida por el vapor en su equilibrio termodinámico con su estado condensado de líquido o sólido. La siguiente tabla ofrece una comparación concisa de estas presiones.
| Presión de vapor | Presión parcial |
| Se ejerce por vapor líquido o sólido en su fase condensada en equilibrio | Es ejercido por gases individuales en una mezcla de gas no reactiva |
| Bien explicado por la ley de Raoult | Bien explicado por la ley de Dalton |
| Aplicable en fases sólidas y líquidas | Aplicable solo en fases gaseosas |
| Independiente del área de superficie o el volumen del sistema | Calculado usando los gases en el mismo volumen |
| Calculado usando la fracción de lunar del soluto | Calculado usando la fracción molar del gas |
Envolver!
La presión de vapor y la presión parcial son dos términos científicos importantes utilizados para determinar los efectos de las fuerzas aplicadas por el vapor y los gases, respectivamente, en un sistema cerrado a temperaturas particulares. Su principal diferencia es el área de aplicación con la presión de vapor aplicada en las fases líquidas o sólidas, mientras que la presión parcial se aplica en un gas individual en una mezcla de gases ideales en un volumen dado.
La presión parcial se calcula fácilmente siguiendo la ley de presiones parciales de Dalton, mientras que la presión de vapor se calcula aplicando la ley de Raoult. En cualquier mezcla dada, cada componente de gas ejerce su propia presión, que se llama presión parcial independiente de otros gases. Y cuando duplique los lunares de cualquier componente con la temperatura que queda constante, aumentará su presión parcial. Según la relación Clausius-Clapeyron [2], la presión del vapor aumenta a medida que aumenta la temperatura.
Con la información antes mencionada, debe poder distinguir entre la presión de vapor y la presión parcial. También debería poder calcularlos usando las fracciones molares y multiplicarse por la presión total. Le hemos dado ejemplos típicos para explicar la aplicación de estas presiones.

