Diferencia entre ácido fuerte y débil
- 2739
- 808
- Juan Carlos Rodrígez
Los ácidos son sustancias químicas que donan iones de hidrógeno o protones cuando se mezclan en soluciones. El número de protones entregados por un ácido particular en realidad determina la fuerza del ácido, ya sea un ácido fuerte o un ácido débil. Para comprender la fuerza de los ácidos, uno debe comparar su tendencia a donar protones a la base similar (principalmente agua). La fuerza se denota por un número llamado PKA.

¿Qué es un ácido fuerte??
Se dice que un ácido es fuerte si se disocia o se ioniza completamente en una solución. Eso significa que es capaz de dar el mayor número de iones o protones H+ cuando se mezcla en una solución. Estos iones son las partículas cargadas. Dado que un ácido fuerte dona un mayor número de iones a medida que se descompone, o ioniza, eso significa que un ácido fuerte es un conductor de electricidad.
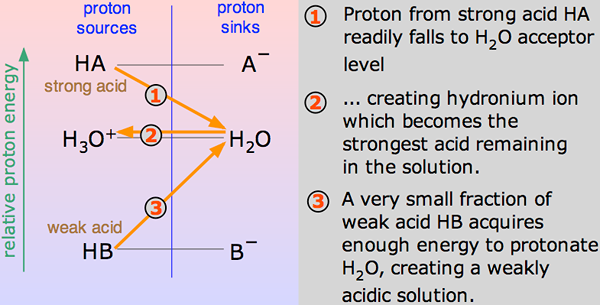
Cuando un ácido se mezcla en h2O, un protón (h+ ion) se lleva a una H2O molécula para generar un H3O+ (Ion hidroxonio) y un ion basado en el cual el ácido está involucrado para comenzar con.
En un escenario general,
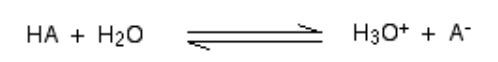
Dichas reacciones químicas pueden ser veneradas, pero en pocos casos, el ácido se revela h+ ion bastante fácilmente y la reacción parece ser unidireccional. Y el ácido se disocia completo.
Delantero.gramo., Cuando el cloruro de hidrógeno se disuelve en H2O Para hacer HCL, se produce tan poca reacción inversa que podemos escribir:

En un momento, el cien por ciento de reacción virtual tendrá lugar en la que el cloruro de hidrógeno mostrará una reacción con H3O+ (Ion hidroxonio) y CL- iones. Aquí, el ácido fuerte es el cloruro de hidrógeno.
¿Qué es un ácido débil??
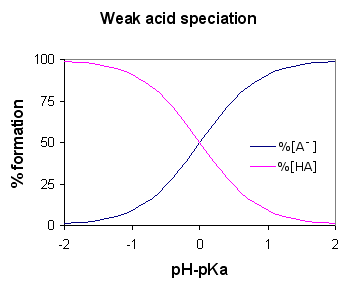
Se dice que un ácido es débil si se ioniza parcial o de manera incompleta, dando solo algunos de sus átomos de hidrógeno en la solución. Por lo tanto, es menos capaz en comparación con un ácido fuerte para emitir protones. Los ácidos débiles tienen PKA más alto que los ácidos fuertes.
El ácido etanoico es un buen ejemplo de un ácido débil. Muestra reacción con H2O para producir H3O+ (Iones de hidroxonio) y CH3COOH (iones de etanoato), pero la reacción inversa muestra más éxito que el delantero. Las moléculas reaccionan con bastante facilidad para mejorar el ácido y la H2O.

En cualquier momento, solo alrededor del uno por ciento de la CH3Las moléculas de ácido de COOH muestran la conversión en iones. Lo que queda es las moléculas simples de ácido acético (sistemáticamente llamado ácido etanoico).
Diferencia entre ácido fuerte y ácido débil
-
Definición
Ácido fuerte
Un ácido fuerte es un ácido que se ioniza completamente en una solución acuosa. Un ácido fuerte siempre perderá un protón (a H+) cuando se disuelve en H2O. En otras palabras, un ácido fuerte siempre está en sus dedos y bastante eficiente para emitir protones.
Ácido débil
Un ácido débil es uno que se ioniza parcialmente en una solución. Da solo unos pocos de sus átomos de hidrógeno a la solución. Por lo tanto, es menos capaz que un ácido fuerte.
-
Conductividad eléctrica
Ácido fuerte
Los ácidos fuertes siempre mostrarán una fuerte conductividad. Los ácidos fuertes generalmente pasan más corriente en comparación con los ácidos débiles para el mismo voltaje y concentración.
Ácido débil
Los ácidos débiles tienen una baja conductividad. Son conductores pobres y muestran un valor bajo para el paso actual
-
Tasa de reacción
Ácido fuerte
La velocidad de reacción es más rápida en los ácidos fuertes
Ácido débil
La velocidad de reacción es más lenta en ácidos débiles
-
Ejemplos
Ácido fuerte
Ácido clorhídrico (HCl), ácido nítrico (HNO3), Ácido perclórico (HCLO4), Ácido sulfúrico (h2ENTONCES4), Ácido hidroiódico (HI), ácido hidrobrómico (HBR), ácido clórico (HCLO3).
Ácido débil
Ácido sulfuroso (h2ENTONCES3), Ácido acético (CH3COOH), ácido fosfórico (h3correos4), Ácido benzoico (c6H5COOH), ácido hidrofluorico (HF), ácido fórmico (HCOOH), ácido nitroso (HNO2).
-
ph
Ácido fuerte
En un ácido fuerte, el pH es más bajo que, generalmente 3. Los ácidos fuertes poseen una concentración muy alta de iones H+ (un ácido que tiene un pH tiene 0.001 moles por litro de iones de hidrógeno).
Ácido débil
Un ácido débil tiene un pH que varía entre 3-7.
-
Valor de PKA
Ácido fuerte
En un ácido fuerte, el valor de PKA es bastante bajo.
Ácido débil
En un ácido débil, el valor de PKA es bastante alto.
-
Disociación
Ácido fuerte
HCl (G)+H2O (L) ≈ H3O+(aq)+cl-(aq)
Ácido débil
Pez3COOH (L)+H2O (L) ≈ H3O+(aq)+ch3ARRULLO-(aq)
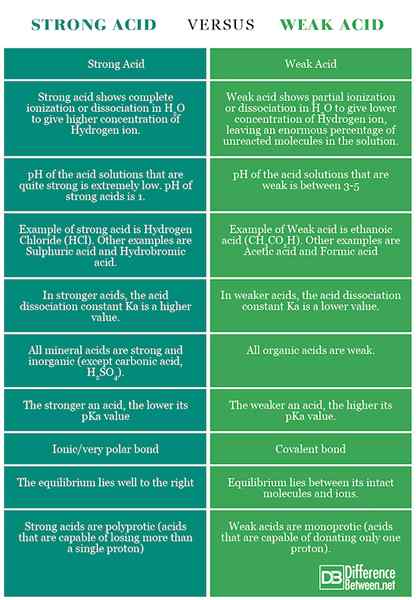
Resumen de ácido fuerte vs. Ácido débil
Los puntos de diferencia entre ácidos fuertes y débiles se han resumido a continuación: Gráfico de comparación
- « Diferencia entre el calor específico y la capacidad de calor
- Diferencia entre clubes de golf masculinos y femeninos »

