Diferencia entre el estado líquido y el estado gaseoso
- 4086
- 636
- Florencia Galindo
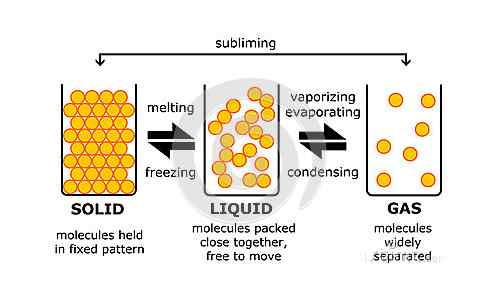
Cualquier cosa que exista físicamente y que tenga masa se define como materia. Por ejemplo, su botella de agua es materia y también lo es el agua. Sin embargo, la pereza que sientes por la mañana o los pensamientos que tienes en tu mente no importan porque no existen físicamente ni tienen masa. Ahora que sabemos lo que importa, podemos agregar a esto diciendo que hay cuatro estados en los que existe la materia. Estos son plasma, sólido, líquido y los estados gaseosos. Los últimos tres son los estados básicos o convencionales de la materia. Casi cualquier cosa que se clasifique como materia se puede convertir en cualquiera de estos tres estados siempre que se cumplan ciertas condiciones. Estos pueden incluir cambios en la presión, temperatura, etc. Tenga en cuenta que aunque casi toda la materia se puede convertir de un estado a otro, a temperatura ambiente requiere algún estado particular. Por ejemplo, H2O es la fórmula química para el agua que existe en estado líquido a temperatura ambiente, pero también puede convertirse en hielo (estado sólido) o vapor (estado gaseoso).
La diferencia entre el líquido y los estados gaseosos está en los niveles moleculares, es decir, debido a diferentes características de las moléculas de las cuales están compuestas. Cualquier líquido está formado por pequeñas partículas que vibran en o cerca de sus posiciones originales. Las partículas se mantienen unidas por fuerzas intermoleculares. Una masa dada de un líquido tiene un volumen fijo, es decir, la región es ocupadas permanecer fija. Si vierte un líquido en un recipiente, entonces el líquido ocupará una región igual a su volumen. Esto no es cierto para la materia en el estado gaseoso. Las pequeñas partículas que componen cualquier gas son libres de moverse. Pueden moverse en cualquier lugar al azar y las fuerzas de atracción entre estas partículas son muy bajas. Son menores que las fuerzas en un líquido y, por lo tanto, el movimiento de un gas se conoce como movimiento aleatorio, mientras que el movimiento de un líquido se conoce como un movimiento de flujo. Además, el volumen de un gas no se fija a diferencia de un líquido. Dado que las partículas están en un movimiento aleatorio, son libres de moverse en cualquier lugar donde puedan. Por lo tanto, el gas tomará el volumen del contenedor. Esto significa que si algún gas está encerrado en un recipiente, tendrá el mismo volumen que el del contenedor. Las partículas se extenderán y ocuparán tanta región como puedan. Si la misma cantidad de gas se desplaza a un recipiente más grande, las partículas de gas ocuparán un volumen mayor. El volumen ha aumentado, por lo tanto,. Por lo tanto, es seguro decir que el volumen de un gas no es fijo.
Debido a las fuerzas de atracción más débiles, las partículas tienen grandes espacios entre ellas en el estado gaseoso. En contraste con esto, las partículas en un líquido tienen un espacio relativamente más bajo entre ellas. Esta es también la razón del volumen fijo de un líquido en lugar de un gas.
La energía de las partículas es otra área donde un gas y un líquido son diferentes. La energía de las partículas también determina los espacios entre ellas y, por lo tanto, el estado del asunto. Las partículas de un gas tienen la mayor energía de los tres estados básicos. Por lo tanto, las partículas muestran un gran movimiento y, por lo tanto, se extienden tanto como puedan. Las partículas de un líquido, sin embargo, tienen menor energía que las de un gas. Por lo tanto, generalmente permanecen muy cerca de sus posiciones iniciales, siempre que otras condiciones sigan siendo las mismas.
Resumen de las diferencias expresadas en los puntos
- Un líquido está formado por pequeñas partículas que vibran en o cerca de sus posiciones originales; Un gas está compuesto por partículas que son libres de moverse en cualquier lugar donde puedan
- El movimiento de un gas es aleatorio; El movimiento de un líquido se llama flujo
- Hay fuerzas de atracción intermeculares más fuertes en líquidos que los gases
- Hay mayor espaciado entre las partículas de un gas que las de un líquido
- Las partículas de un gas tienen mayor energía que las de un líquido
- Las razones mencionadas anteriormente representan el volumen fijo de un líquido, pero el volumen de un gas no se fija y es igual al volumen del contenedor en el que está en


