Alotropas vs. Isómeros

- 1015
- 234
- María Elena Elizondo
Alotropos son diferentes modificaciones estructurales de un elemento mientras isómeros son compuestos químicos que comparten la misma fórmula molecular pero tienen diferentes fórmulas estructurales.
Ciertos elementos pueden existir en dos o más formas diferentes. Estas formas se llaman alotropos en el que los átomos del elemento se unen de manera diferente. Por ejemplo, dioxígeno (O2), ozono (o3), tetraoxígeno (o4) y octaxígeno (o8) son alotropos de oxígeno. Otro ejemplo es el carbono cuyos alotropos incluyen grafito y diamante. En resumen, los alotropos contienen el mismo elemento (los mismos átomos) que se unen de diferentes maneras para producir diferentes estructuras moleculares.
A diferencia de, isómeros son compuestos (Ver Elementos VS. Compuestos) que comparten la misma fórmula molecular pero tienen diferentes fórmulas estructurales. Los isómeros no comparten sus propiedades químicas a menos que pertenezcan al mismo grupo funcional. Por ejemplo, el propanol tiene la fórmula C3H8O (o C3H7Oh) y ocurre como dos isómeros: propan-1-ol (alcohol n-propilo; I) y propan-2-ol (alcohol isopropílico; II). La diferencia entre los dos isómeros se encuentra en la posición del átomo de oxígeno: está unido a un carbono final en propan-1-ol, y al carbón central en propan-2-ole. Hay un tercer isómero de c3H8O cuyas propiedades son tan diferentes que no es un alcohol (como propanol) sino un éter. Llamado metoxietano (metil-etil-ether; III), este isómero tiene un oxígeno conectado a dos carbonos en lugar de a un carbono y un hidrógeno.
Cuadro comparativo
| Alotropos | Isómeros | |
|---|---|---|
| Definición | Los alotropos son diferentes modificaciones estructurales de un elemento. Por ejemplo O y O2 | Los isómeros son compuestos químicos que comparten la misma fórmula molecular pero tienen diferentes fórmulas estructurales. |
| Ejemplos | Diamante, grafito, etc. | 2-metilpropan-1-ol y 2-metilpropan-2-ol. |
Historia de alotropas e isómeros
Tanto la alotropía como el isomerismo fueron conceptos propuestos por el científico sueco Jöns Jakob Berzelius. Propuso el concepto de alotropía en 1841. Después de la aceptación de la hipótesis de Avogadro en 1860, se entendió que los elementos podrían existir como moléculas poliatómicas, y los dos alótropos de oxígeno fueron reconocidos como o2 y o3. A principios del siglo XX se reconoció que otros casos como el carbono se debieron a diferencias en la estructura cristalina.
El isomerismo se notó por primera vez en 1827, cuando Friedrich Woehler preparó ácido ciano y señaló que aunque su composición elemental era idéntica al ácido fulminico (preparado por Justus von Liebig el año anterior), sus propiedades eran bastante diferentes. Este hallazgo desafió la comprensión química prevaleciente del tiempo, que sostenía que los compuestos químicos podrían ser diferentes solo cuando tenían diferentes composiciones elementales. Después de que se hicieron descubrimientos adicionales del mismo tipo, como el descubrimiento de 1828 de Woehler de que Urea tenía la misma composición atómica que el cianato de amonio químicamente distinto, Jöns Jakob Berzelius introdujo el término isomerismo para describir el fenómeno.
Tipos de isómeros
Diferentes clases de isómeros incluyen estereoisómeros, enantiómeros y isómeros geométricos.
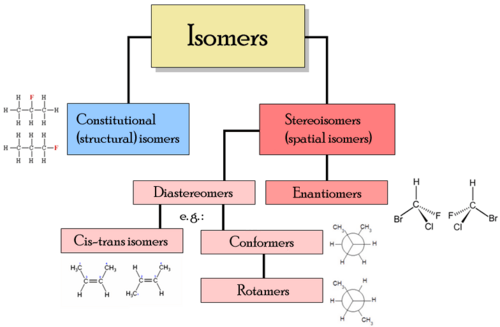 Tipos de isómeros
Tipos de isómeros - Isómeros estructurales - En los isómeros estructurales, los átomos y los grupos funcionales se unen de diferentes maneras. Los tipos de isómeros estructurales incluyen:
- isomerismo de la cadena - Las cadenas de hidrocarburos tienen cantidades variables de ramificación
- Posición del isomerismo - se ocupa de la posición de un grupo funcional en una cadena
- Isomerismo del grupo funcional - Un grupo funcional se divide en diferentes.
- isómeros esqueléticos - La cadena principal de carbono es diferente entre los dos isómeros.
- Tautómeros - isómeros estructurales de la misma sustancia química que se interconviertan espontáneamente entre sí.
- Estereoisómeros - En los estereoisómeros, la estructura del enlace es la misma, pero el posicionamiento geométrico de los átomos y los grupos funcionales en el espacio es diferente. Los tipos de estereoisómeros incluyen:
- enantiómeros - Diferentes isómeros son imágenes de espejo no superposibles entre sí
- diastereómeros - Los isómeros no son imágenes de Mirro el uno del otro

