Diferencia entre cristalino y amorfo

- 1415
- 398
- Miguel Arias
Amorfo y cristalino son dos estados que describen sólidos típicos en la química. Usando experimentos de difracción de rayos X, la estructura de los sólidos se puede clasificar en cristalino o amorfo (no cristalino).
Los sólidos se encuentran entre los tres estados básicos de la materia que incluyen líquidos y gases. Se caracterizan por una estructura rígida de moléculas, iones y átomos dispuestos de manera ordenada o no ordenada. Estos arreglos ordenados o no ordenados han llevado a la categorización como amorfo y cristalino y este artículo desarrolla las diferencias clave entre los dos términos.

Que es cristalino?
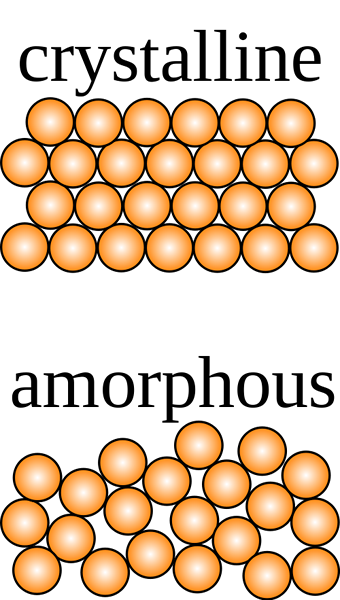
Un sólido cristalino es aquel en el que las partículas constituyentes están ordenadas ordenadas en un patrón tridimensional llamado red de cristal con fuerzas intermoleculares uniformes, y las partículas se cruzan en ángulos característicos del cristal.
La estructura interna tiene una forma geométrica distinta, y muestra una escisión clara cuando se corta en cualquier parte de la estructura. El patrón tridimensional visto usando los rayos X se usa para identificar el sólido. Sin embargo, no es fácil detectar la diferencia entre sólidos cristalinos y no cristalinos al tocarlos. Difieren entre sí en muchos aspectos, incluidas las propiedades químicas y físicas.
Los sólidos cristalinos (cristales) necesitan temperaturas extremas para romper las fuerzas intermoleculares. Tienen un calor definido de fusión y puntos de fusión debido a la disposición uniforme de sus componentes. El entorno local también es uniforme. Sin embargo, cuando se cortan en cualquier dirección, las propiedades físicas son diferentes, por lo tanto, conocidas como anisotrópicas. Cuando se gira alrededor del eje, la estructura de los cristales sigue siendo la misma y eso se denomina disposición simétrica de moléculas, átomos o iones.
Algunos sólidos cristalinos pueden terminar siendo amorfos dependiendo del proceso de enfriamiento. Otros pueden tener sus componentes desalineados debido a la presencia de impurezas. Además, las sustancias de enfriamiento rápidamente pueden conducir a una estructura amorfa con formas geométricas irregulares. El cuarzo, por ejemplo, es cristalino con átomos de silicona y oxígeno de manera ordenada. Pero, cuando se enfría rápidamente, puede conducir al vidrio de la estructura amorfa. Ocurre normalmente que el proceso de cristalización se evita por sustancias que se fusión rápidamente para producir sólidos amorfos debido a sus extensas aplicaciones industriales. El caucho, el polímero y el vidrio se encuentran entre los ejemplos perfectos de sólidos amorfos importantes utilizados en gran medida para sus inmensos beneficios y propiedades isotrópicas únicas.
El índice de refracción, la resistencia mecánica, la conductividad térmica y la conductividad eléctrica de los sólidos cristalinos difieren en diferentes direcciones. Esa es la desventaja de este tipo de sólidos en comparación con los sólidos no cristalinos. El lado bueno de un sólido anisotrópico es que denota una estructura interna perfectamente dispuesta con fuerzas uniformes de atracciones en una red de cristal. Representa las propiedades verdaderas de un sólido con orden de largo alcance y una estructura rígida.
Que es amorfo?
La palabra amorfo se deriva de la palabra griega amorfo que significa "sin forma". Esta es la disposición sin forma, desordenada e irregular de las partículas constituyentes de un sólido. Sus fuerzas intermoleculares no son las mismas, ni las distancias entre las partículas. Cuando se escinden, los sólidos amorfos producen fragmentos o superficies curvas debido a formas geométricas irregulares.
Algunos sólidos amorfos pueden tener partes de patrones ordenados ordenados que se llaman cristalitos. Los átomos, iones o moléculas del sólido dependen del proceso de enfriamiento. Como se mencionó anteriormente, el cristal de cuarzo difiere con vidrio de cuarzo debido al proceso de cristalización. Pero, en general, muchos sólidos amorfos tienen un patrón desordenado. Por lo general, se les llama sólidos súper enfriados porque la estructura comparte algunas propiedades con líquidos. Además, no muestran las verdaderas propiedades de los sólidos, pero, sin embargo, se usan predominantemente en numerosas aplicaciones.
La conductividad térmica, la resistencia mecánica, la conductividad eléctrica y el índice de refracción son las mismas en todas las direcciones de sólidos amorfos. Esto explica de dónde proviene el nombre isotrópico. Los sólidos no tienen puntos de fusión agudos o un calor definido de fusión. Se debe aplicar una amplia gama de temperatura antes de que puedan derretirse debido a la ausencia de una matriz ordenada de componentes. Además, los sólidos amorfos se caracterizan por un orden de corto alcance. Ejemplos de sólidos amorfos incluyen polímeros, gomas, plásticos y vidrio.
Si se deja un sólido amorfo durante mucho tiempo por debajo de su punto de fusión, puede transformarse en un sólido cristalino. Puede representar las mismas propiedades poseídas por los sólidos cristalinos.
Diferencias clave entre amorfo y cristalino
Estructura de cristalino y amorfo
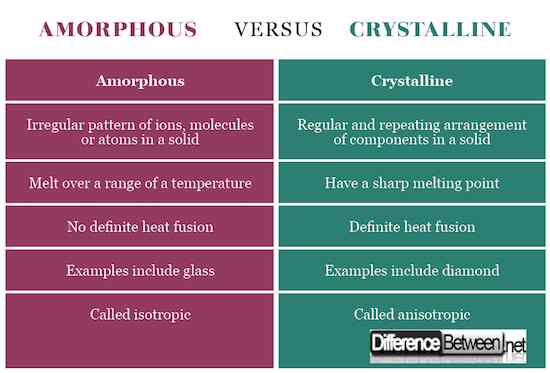
Los sólidos cristalinos tienen una forma definitiva con iones ordenados ordenados, moléculas o átomos en un patrón tridimensional a menudo denominado red de cristal. Si se cortan, representan un escote claro con superficies que se cruzan en ángulos que son característicos del cristal. Los sólidos amorfos, por otro lado, tienen una variedad de componentes desordenados que no muestran una forma definitiva. Cuando se cortan, muestran formas irregulares generalmente con superficies curvas. Los componentes cristalinos se mantienen unidos por fuerzas intermoleculares uniformes, mientras que en los sólidos amorfos estas fuerzas difieren de un átomo a otro.
Puntos de fusión de cristalino y amorfo
Los sólidos amorfos no tienen puntos de fusión definidos, sino que se derriten en un amplio rango de temperatura debido a la forma irregular. Los sólidos cristalinos, por otro lado, tienen un punto de fusión agudo.
Propiedades físicas de cristalino y amorfo
Los sólidos cristalinos poseen diferentes conductividad eléctrica, conductividad térmica, índice de refracción y resistencia mecánica dentro de un cristal en diferentes direcciones, por lo tanto, se denominan anisotrópicos. Amorfo se llama isotrópico debido a propiedades físicas similares desde cualquier dirección.
Ejemplos de cristalino y amorfo
Ejemplos de un sólido cristalino incluyen NaCl, azúcar y diamante, mientras que los ejemplos de sólidos amorfos incluyen vidrio, caucho y polímeros.
Vea la tabla de comparación para los versos cristalinos amorfos a continuación:
Resumen de los versos cristalinos amorfos
- Los sólidos cristalinos tienen un patrón de tridimensión regular de iones, átomos o moléculas, mientras que los sólidos amorfos tienen una disposición aleatoria de estos componentes
- Los sólidos cristalinos tienen un punto de fusión exacto, mientras que los sólidos amorfos se derriten en un rango de temperatura
- Los sólidos amorfos producen fragmentos con patrones irregulares cuando se escinden, mientras que los sólidos cristalinos representan una forma definitiva
- Cristalino llamado anisotrópico debido a diferentes propiedades físicas en todas las direcciones, mientras que amorfos se llaman isotrópicos
- Ejemplos de amorfos incluyen vidrio y el de Crystalline incluyen diamantes.

