Diferencia entre los espectros de emisión y absorción
- 1739
- 306
- Carmen Arreola

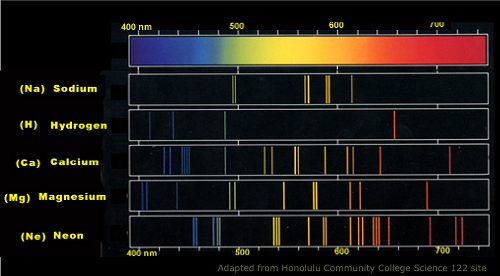
Espectro de emisión atómica de sodio
Emisión vs. Espectro de absorción
Un químico con el objetivo de descubrir la composición elemental de una sustancia o solución específica puede diferenciar los átomos a través de la emisión y/o la espectroscopía de absorción. Ambos procesos están orientados a la observación de los electrones y fotones cuando se someten a luz. Luego se necesita un espectrofotómetro junto con una fuente de luz en estos procesos. El científico debe tener una lista de valores para ambas emisiones de absorción para cada átomo antes de someter la sustancia a la espectroscopía.
Por ejemplo, cuando el científico descubre una muestra de un área lejana y tiene como objetivo aprender la composición del asunto, puede optar por someter la muestra a la espectroscopía de emisión o absorción. En los espectros de absorción, se supone que debe observar cómo los electrones de los átomos absorben la energía electromagnética de la fuente de luz. Cuando la luz se dirige hacia átomos, iones o moléculas, las partículas tienden a absorber longitudes de onda que pueden excitarlas y hacer que se muevan de un cuántico a otro. El espectrofotómetro puede registrar la cantidad de longitud de onda absorbida, y el científico puede referirse a la lista de características del elemento para determinar la composición de la muestra reunida.
Los espectros de emisión se realizan con el mismo proceso de sujeción de luz. Sin embargo, en estos procesos, el científico observa la cantidad de energía de luz o calor emitida por los fotones del átomo que los hace volver a su cuántico original.
Piénselo de esta manera: el sol es el centro del átomo, que consiste en fotones y neutrones. Los planetas que orbitan el sol son los electrones. Cuando se dirige una linterna gigante hacia la tierra (como un electrón), la tierra se excita y se mueve hacia la órbita de Neptuno. La energía absorbida por la tierra se registra en los espectros de absorción.
Cuando se retira la linterna gigante, la tierra emite luz para que vuelva a su estado original. En tales casos, el espectrofotómetro registra la cantidad de longitud de onda emitida por la Tierra para que el científico determine el tipo de elementos compuestos por el sistema solar.
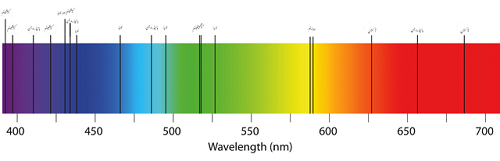
Espectro de absorción de pocos elementos
Además de esto, la absorción no necesita la excitación de los iones o átomos, a diferencia de los espectros de emisión. Ambos necesitan tener una fuente de luz, pero estos deberían variar en los dos procesos. Las lámparas de cuarzo generalmente se usan en absorción, mientras que los quemadores son adecuados para los espectros de emisión.
Otra diferencia entre los dos espectros se encuentra en la salida de "impresión". Al desarrollar una imagen, por ejemplo, el espectro de emisión es la fotografía de color, mientras que el espectro de absorción es la impresión negativa. He aquí por qué: los espectros de emisión pueden emitir luz que se extiende a los diferentes rangos del espectro electromagnético, produciendo así líneas de colores con ondas de radio de baja energía a los rayos gamma de mayor energía. Los colores en el prisma generalmente se observan en estos espectros.
Por otro lado, la absorción puede emitir varios colores junto con líneas en blanco. Esto se debe a que los átomos absorben la luz a una frecuencia que depende del tipo de elementos presentes en la muestra. Es poco probable que la luz reemitida en el proceso se emita en la misma dirección en la que se originó el fotón absorbido. Dado que la luz del átomo no se puede dirigir hacia el científico, las luces parecen tener líneas negras debido a las ondas faltantes en los espectros electromagnéticos.
Resumen:
1.Los espectros de emisión y absorción se pueden usar para determinar la composición de la materia.
2.Ambos usan una fuente de luz y un espectrofotómetro.
3.Los espectros de emisión miden la longitud de onda de la luz emitida después de que los átomos se excitan con calor, mientras que la absorción mide la longitud de onda absorbida por el átomo.
4.Los espectros de emisión emiten todos los colores en el espectro electromagnético, mientras que la absorción puede tener algunos colores faltantes debido a la redirección de la reemisión de fotones absorbidos.

