Diferencia entre la molaridad y la molalidad
- 4076
- 915
- Florencia Galindo
¿Qué es la molaridad??
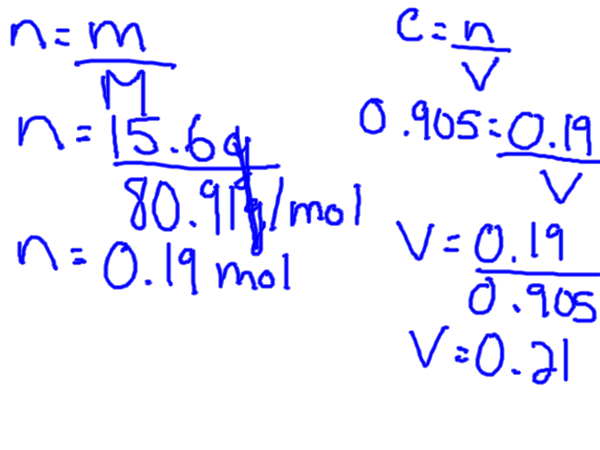
La molaridad se puede definir como el número de moles de una sustancia (conocido como el soluto) que se disuelve precisamente 1 litro de solución (solvente y soluto combinado).
Por lo tanto, la fórmula para calcular la molaridad es la siguiente:
M = solución de soluto topo / L
La molaridad también se conoce comúnmente como concentración molar. Por lo tanto, una medida de concentración molar basada en el volumen de líquido en el que se disuelve una sustancia en. Es importante darse cuenta de que el volumen está en litros, por lo que es posible que deba convertir primero si tiene volumen en ML, por ejemplo,.
Para preparar una concentración molar, se agrega una cantidad conocida de soluto a un matraz volumétrico y luego llena el matraz con líquido hasta que se logre la marca de 1 litro.

Por ejemplo: Uno puede inventar una cierta concentración molar de azúcar. El peso del azúcar primero debe convertirse en lunares y luego se agrega el agua hasta que se alcanza 1 litro.
Para calcular la molaridad, necesita el soluto en lunares, pero generalmente tendrá un cierto peso de soluto, lo que significa que primero debe convertir los gramos en lunares. Esto se puede hacer al encontrar la masa molar del soluto de la tabla periódica.
La fórmula de concentración molar se puede reorganizar para resolver tanto el volumen como para los lunares.
El volumen está influenciado por los cambios en la temperatura o la presión. Por ejemplo, el volumen aumentaría con el aumento de la temperatura. Esto significa que habrá alguna cuestión de precisión en los que hay cambios en la temperatura.
Si la temperatura disminuye lo suficiente, entonces el líquido puede contraerse que aumenta la molaridad porque permanece el mismo número de moles, pero habría menos solución.
Por el contrario, si la temperatura aumenta lo suficiente, entonces el líquido puede expandirse, lo que disminuye la molaridad porque permanece el mismo número de lunares, pero habría más solución presente.
La molaridad se puede usar para calcular la concentración de una sustancia que se ha diluido.
La molaridad se puede usar cuando no se requiere precisión exacta. Sin embargo, está influenciado por los cambios de temperatura porque es una medición volumétrica, por lo que en algunos casos puede no ser apropiado usar.
La molaridad y la molalidad pueden ser las mismas en algunos casos. Por ejemplo, 1 litro de agua pesa 1 kg.
¿Qué es la molalidad??
La molalidad se puede definir como el número de moles de sustancia (conocido como el soluto) que se encuentra en una cierta masa de solvente dada en kg, que se disuelve en.
La fórmula para calcular la molalidad es :
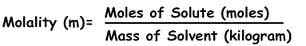
M = soluto topo / kg solvente
La molalidad también se conoce como concentración molal.
Un ejemplo de hacer una concentración molal sería peso una cierta cantidad de azúcar, por ejemplo,. Esto debe convertirse en el número de moles utilizando la masa molecular del azúcar. Luego se pesa un vaso de agua y se agrega agua al vaso de precipitados hasta que pesa 1 kg.
Luego se agrega el azúcar al vaso de agua y se disuelve.
La ventaja de la molalidad sobre la molaridad es que no se ve afectado por los cambios en la temperatura y la presión, ya que se calcula en función de la masa y no el volumen. La masa del solvente no se ve afectada por la temperatura en la forma en que el volumen de una sustancia es, por lo tanto, la molalidad es una medida más precisa de la concentración que la molaridad.
En el caso del agua, la molaridad y la molalidad pueden ser las mismas ya que 1 litro de agua pesa 1 kg, sin embargo, este puede no ser el caso con todos los líquidos.
Esto significa que la molalidad debe usarse cuando se refieren a las propiedades de coligeración.
La molalidad es más precisa y proporciona una mayor precisión de la concentración, pero tarda más en prepararse, ya que el soluto debe agregarse al peso de un solvente. Si el solvente es líquido, entonces esto debe sopesarse.
Esto se puede hacer utilizando un sistema gravimétrico y un equilibrio analítico para sopesar el solvente.
¿Cuál es la diferencia entre molaridad y molalidad??
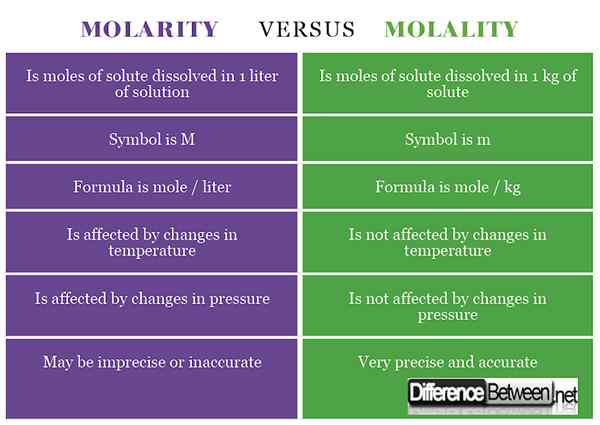
1) La molaridad es la concentración de una sustancia que se calcula como el número de moles de soluto que se disuelve en 1 litro de solución, mientras que la molalidad es la concentración de una sustancia que se calcula como el número de moles de soluto que se encuentra en 1 kg de solvente.
2) El símbolo de la molaridad es M, mientras que para la molalidad es M (a veces escrito como -M o metro para distinguirlo de la masa).
3) La fórmula para la molaridad es moles / litro, mientras que la fórmula para la molalidad es moles / kg.
4) La molaridad se ve afectada por los cambios de temperatura, mientras que la molalidad no se ve afectada por los cambios en la temperatura.
5) La molaridad se ve afectada por los cambios en la presión, mientras que la molalidad no se ve afectada por los cambios en la presión.
6) La molaridad puede dar lugar a una concentración imprecisa e inexacta, mientras que la molalidad da como resultado una medición precisa precisa de la concentración.
Tabla que comparó la molaridad y la molalidad
Resumen de molaridad y molalidad
- Tanto la molaridad como la molalidad se pueden usar para medir la concentración.
- La molaridad se define como el número de moles de un soluto que se disuelve en 1 litro de una solución.
- La molalidad se define como el número de moles de un soluto que se disuelve en 1 kg de un solvente.
- La molalidad es un medio más preciso y preciso para hacer una cierta concentración porque no se ve afectado por los cambios de temperatura y presión.
- La molaridad implica un líquido, lo que significa que la concentración puede cambiar. Esto se debe a que el volumen es un líquido puede cambiar con los cambios en la temperatura y la presión.
- « Diferencia entre discapacidad intelectual y discapacidad del desarrollo
- Diferencia entre Groupby y Orderby »

