Diferencias entre inhibidores enzimáticos irreversibles e inhibidores de enzimas reversibles
- 3179
- 489
- Carmen Arreola
Los inhibidores enzimáticos son moléculas y iones pequeños capaces de unirse a las enzimas para reducir su actividad catalítica. La inhibición de la enzima es un mecanismo de control importante en los sistemas biológicos. Además, es el proceso utilizado por muchos medicamentos en la reducción efectiva de la actividad enzimática mediada por la enfermedad. Los inhibidores enzimáticos pueden clasificarse como irreversibles y reversibles.
¿Qué son inhibidores de enzimas irreversibles??
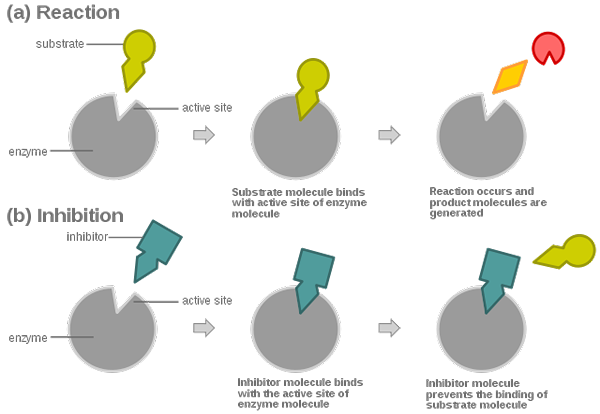
Los inhibidores irreversibles se unen firmemente a la enzima, disociándose muy lentamente de ella. Pueden formar enlaces covalentes o no covalentes con su objetivo.
Muchas drogas importantes, como la penicilina, son inhibidores de enzimas irreversibles. La penicilina es un antibiótico capaz de matar bacterias al unirse covalentemente a la enzima transpeptidasa, lo que evita la síntesis de la pared celular bacteriana.
Otro ejemplo es la aspirina, que forma enlaces covalentes con la enzima ciclooxigenasa, lo que resulta en la reducción de los procesos inflamatorios.
Los inhibidores irreversibles se pueden clasificar en tres categorías: reactivos específicos del grupo, análogos de sustrato e inhibidores de suicidio.
Los reactivos específicos del grupo pueden unirse a un residuo de aminoácidos particular de la enzima y modificarlo irreversiblemente. Por lo tanto, son menos específicos, pueden interactuar con muchas enzimas.
Los análogos de sustrato presentan una estructura similar al sustrato de la enzima y pueden modificar covalentemente su residuo de sitio activo.
Los inhibidores del suicidio son los inhibidores enzimáticos más específicos. Se unen como sustrato a la enzima y se procesan a través de la reacción catalítica. La catálisis genera un intermedio que inactiva covalentemente la enzima.

¿Qué son los inhibidores de enzimas reversibles??
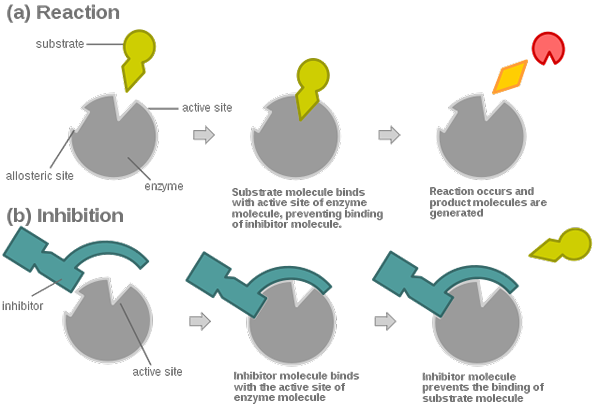
Los inhibidores reversibles forman enlaces no covalentes con la enzima. Se caracterizan por una rápida disociación de su objetivo.
Los inhibidores reversibles se pueden clasificar en dos categorías principales, inhibidores competitivos y no competitivos.
Un inhibidor reversible es competitivo cuando la enzima puede unirse con su sitio activo, ya sea al inhibidor que forma un complejo enzimático inhibidor (EI), o al sustrato que forma un complejo enzimático subtrato (ES).
En este caso de inhibición competitiva, la unión de la enzima al sustrato o al inhibidor es mutuamente excluyente: la enzima nunca puede unirse al inhibidor y al sustrato al mismo tiempo.
La reducción de la actividad catalítica de la enzima se logra mediante la reducción de la proporción del complejo enzimático-sustrato.
El aumento de la concentración de sustrato puede aliviar la inhibición de la enzima.
En la inhibición no competitiva reversible, el sustrato y el inhibidor se unen simultáneamente a diferentes sitios de la enzima, lo que lo hace inactivo. Esta inhibición no puede superarse aumentando la concentración del sustrato.
Diferencia y similitudes entre los inhibidores de la enzima irreversible y reversible
- Los inhibidores enzimáticos irreversibles e inhibidores de la enzimas reversibles son capaces de unirse a las enzimas y reducir su actividad catalítica.
- Los inhibidores irreversibles se unen firmemente a la enzima objetivo, y la disociación del complejo enzimático inhibidor es muy lenta. El efecto de inhibición es irreversible. Los inhibidores reversibles, en el otro lado, se caracterizan con una rápida disociación del complejo enzimático inhibidor. El efecto de inhibición es reversible.
- Los inhibidores irreversibles se pueden clasificar en tres categorías: reactivos específicos del grupo, análogos de sustrato e inhibidores de suicidio. Los inhibidores reversibles se clasifican en dos grupos: inhibidores competitivos y no competitivos.
- Los análogos de sustrato irreversibles y los inhibidores competitivos reversibles actúan de manera similar imitando el sustrato específico de enzimas. Los análogos de sustrato modifican irreversiblemente el sitio activo de la enzima, mientras que la inhibición competitiva puede revertirse aumentando la concentración del sustrato.
Inhibidores de enzimas reversibles irreversibles vs reversibles: tabla de comparación

Resumen
Los inhibidores de enzimas irreversibles y reversibles son moléculas capaces de unirse a las enzimas e inactivarlas.
Si bien los inhibidores irreversibles actúan de manera más permanente modificando sitios activos y disociando lentamente de su enzima objetivo, los inhibidores reversibles se caracterizan por una rápida disociación de la enzima y su actividad de inhibición puede revertirse fácilmente.

