Homogéneo vs. Mezclas heterogéneas

- 3656
- 675
- Rubén Alarcón
Las mezclas son diferentes de sustancias puras como elementos y compuestos porque las mezclas contienen diferentes sustancias que se combinan físicamente pero no químicamente. Los componentes individuales en una mezcla conservan su identidad.
Las mezclas son de dos tipos: homogéneas y heterogéneas. Una mezcla homogénea tiene una composición y apariencia uniformes. Las sustancias individuales que constituyen una mezcla homogénea no se pueden diferenciar visualmente. Por otro lado, una mezcla heterogénea comprende dos o más sustancias que pueden observarse claramente, e incluso se separan relativamente fácilmente.
Cuadro comparativo
Diferencias - similitudes -| Heterogéneo | Homogéneo | |
|---|---|---|
| Uniforme | No | Sí |
| Puedes ver las piezas | Sí | No |
| Puede separarse físicamente | Sí | No |
| Ejemplos | Ensalada, mezcla de senderos | Aceite de oliva, acero, sal en agua |
| Unido químicamente | No | No |
Características físicas
Todas las mezclas comprenden dos o más sustancias puras (elementos o compuestos). La diferencia entre una mezcla y un compuesto es cómo se combinan los elementos o sustancias para formarlos. Los compuestos son sustancias puras porque solo contienen un tipo de molécula. Las moléculas están hechas de átomos que se han unido. Pero en una mezcla, los elementos y los compuestos se encuentran entremezclados físicamente pero no químicamente-No se forman enlaces atómicos entre las sustancias puras que constituyen la mezcla.
Pero independientemente de los enlaces atómicos, las mezclas pueden volverse bastante cohesivas. Comunmente llamado soluciones, Las mezclas homogéneas son aquellas donde las sustancias se mezclan tan bien que no se pueden ver individualmente en una forma diferenciada y distinta. Su composición es uniforme i.mi., lo mismo a lo largo de la mezcla. Esta uniformidad se debe a que los componentes de una mezcla homogénea ocurren en la misma proporción en cada parte de la mezcla.
Por el contrario, una mezcla heterogénea es aquella en la que las sustancias constituyentes no se distribuyen uniformemente. A menudo se pueden contar visualmente y incluso separarse con relativa facilidad, aunque existen muchos métodos para separar las soluciones homogéneas también.
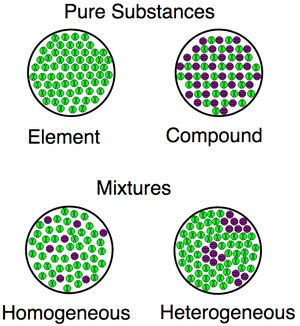 Una visualización para las diferencias entre sustancias (compuestos, elementos) y mezclas (tanto homogéneas como heterogéneas).
Una visualización para las diferencias entre sustancias (compuestos, elementos) y mezclas (tanto homogéneas como heterogéneas). Ejemplos de mezclas homogéneas y heterogéneas
Ejemplos de mezclas heterogéneas serían cubitos de hielo (antes de derretirse) en refrescos, cereales en leche, varios ingredientes en una pizza, ingredientes en yogurt congelado, una caja de tuercas variadas. Incluso una mezcla de aceite y agua es heterogénea porque la densidad del agua y el aceite es diferente, lo que evita la distribución uniforme en la mezcla.
Ejemplos de mezclas homogéneas son batidos, jugo de vegetales mezclados, azúcar disuelto en café, alcohol en agua y aleaciones como el acero. Incluso el aire que está en nuestra atmósfera es una mezcla homogénea de varios gases y dependiendo de la ciudad en la que vive en colutantes. Muchas sustancias, como la sal y el azúcar, se disuelven en agua para formar mezclas homogéneas.
Tipos de mezclas
Hay tres familias de mezclas: soluciones, suspensiones y coloides. Las soluciones son homogéneas, mientras que las suspensiones y coloides son heterogéneos.
Solución
Soluciones son mezclas homogéneas que contienen un soluto disuelto en un solvente, e.gramo. sal disuelta en agua. Cuando el solvente es agua, se llama solución acuosa. La relación de masa del soluto al solvente se llama concentración de la solución.
Las soluciones pueden ser líquidas, gaseosas o incluso sólidas. No solo eso, los componentes individuales de la solución pueden ser diferentes estados de la materia. El soluto supone la fase (sólida, líquida o gaseosa) del solvente cuando el disolvente es la fracción más grande de la mezcla.
- Soluciones gaseosas: cuando el solvente es un gas, solo es posible disolver solutos gaseosos en él. El ejemplo más común de una solución gaseosa es el aire en nuestra atmósfera, que es el nitrógeno (el disolvente) y tiene solutos como el oxígeno y otros gases.
- Soluciones líquidas: los solventes líquidos son capaces de disolver cualquier tipo de solutos.
- Gas en líquido: los ejemplos incluyen oxígeno en agua o dióxido de carbono en agua.
- Líquido en líquido: ejemplo incluye bebidas alcohólicas; Son soluciones de etanol en el agua.
- Sólido en líquido: las soluciones de azúcar o sal en agua son ejemplos de tales mezclas. Muchas mezclas sólidas en líquidos no son homogéneas, por lo que no son soluciones. Podrían ser coloides o suspensiones.
- Soluciones sólidas: los solventes sólidos también pueden disolver solutos de cualquier estado de materia.
- Gas en sólido: un ejemplo de esto es el hidrógeno disuelto en el paladio
- Líquido en sólido: ejemplos de esto incluyen mercurio en oro, formar una amalgama y agua (humedad) en sal
- Sólido en sólido: aleaciones como acero, latón o bronce son un ejemplo de tales mezclas.
Suspensión
Una suspensión es una mezcla heterogénea que contiene partículas sólidas que son lo suficientemente grandes para la sedimentación. Las partículas sólidas no se disuelven en el solvente, sino que están suspendidas y flotando libremente. Son más grandes de 1 micrómetro y generalmente son lo suficientemente grandes como para ser visibles a simple vista. Un ejemplo es la arena en el agua. Una característica clave de las suspensiones es que las partículas suspendidas se asientan con el tiempo si no se molestan.
Coloide
Los coloides son heterogéneos como las suspensiones, pero visualmente parecen ser homogéneas porque las partículas en la mezcla son muy pequeñas 1 nanómetro a 1 micrómetro. La diferencia entre coloides y suspensiones es que las partículas en los coloides son más pequeñas y que las partículas no se asentarán con el tiempo.
| Solución | Coloide | Suspensión | |
|---|---|---|---|
| Homogeneidad | Homogéneo | Heterogéneo a nivel microscópico pero visualmente homogéneo | Heterogéneo |
| Tamaño de partícula | < 1 nanometer (nm) | 1 nm - 1 micrómetro (μm) | > 1 μm |
| Físicamente estable | Sí | Sí | Necesita agentes estabilizadores |
| Exhibe efecto tyndall | No | Sí | Sí |
| Separa por centrífuga | No | Sí | Sí |
| Separa por decantación | No | No | Sí |
Tecnicismo
Hasta cierto punto, se podría decir (si estuviera siendo pedante) que la cuestión de si una mezcla es homogénea o heterogénea depende de la escala a la que se muestrean la mezcla.
Si la escala de muestreo está bien (pequeña), podría ser tan pequeña como una sola molécula. En ese caso, cualquier muestra se volvería heterogénea porque puede ser claramente delineada a esa escala. Del mismo modo, si la muestra es toda la mezcla, podría considerar que es lo suficientemente homogénea.
Entonces, para seguir siendo prácticos, usamos esta regla general para decidir si una mezcla es homogénea: si la propiedad de interés de la mezcla es la misma independientemente de qué muestra se tome para el examen utilizado, la mezcla es homogénea.

